 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cobalt | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Pronunciation | ( | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Appearance | hard lustrous bluish gray metal | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Standard atomic weight Ar°(Co) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cobalt in the periodic table | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic number (Z) | 27 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Group | group 9 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Period | period 4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Block | d-block | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electron configuration | [Ar] 3d7 4s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrons per shell | 2, 8, 15, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physical properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase at STP | solid | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Melting point | 1768 K (1495 °C, 2723 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Boiling point | 3200 K (2927 °C, 5301 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Density (near r.t.) | 8.90 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| when liquid (at m.p.) | 8.86 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of fusion | 16.06 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of vaporization | 377 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar heat capacity | 24.81 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Vapor pressure
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidation states | −3, −1, 0, +1, +2, +3, +4, +5[3] (an amphoteric oxide) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativity | Pauling scale: 1.88 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionization energies |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic radius | empirical: 125 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Covalent radius | Low spin: 126±3 pm High spin: 150±7 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Spectral lines of cobalt | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Other properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Natural occurrence | primordial | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | hexagonal close-packed (hcp)
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Speed of sound thin rod | 4720 m/s (at 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal expansion | 13.0 µm/(m⋅K) (at 25 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal conductivity | 100 W/(m⋅K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrical resistivity | 62.4 nΩ⋅m (at 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetic ordering | ferromagnetic | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Young’s modulus | 209 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Shear modulus | 75 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bulk modulus | 180 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poisson ratio | 0.31 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohs hardness | 5.0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vickers hardness | 1043 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brinell hardness | 470–3000 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS Number | 7440-48-4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| History | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Discovery and first isolation | Georg Brandt (1735) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Main isotopes of cobalt
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| references |
Cobalt is a chemical element with the symbol Co and atomic number 27. As with nickel, cobalt is found in the Earth’s crust only in a chemically combined form, save for small deposits found in alloys of natural meteoric iron. The free element, produced by reductive smelting, is a hard, lustrous, silver-gray metal.
Cobalt-based blue pigments (cobalt blue) have been used since ancient times for jewelry and paints, and to impart a distinctive blue tint to glass, but the color was for a long time thought to be due to the known metal bismuth. Miners had long used the name kobold ore (German for goblin ore) for some of the blue-pigment-producing minerals; they were so named because they were poor in known metals, and gave poisonous arsenic-containing fumes when smelted.[4] In 1735, such ores were found to be reducible to a new metal (the first discovered since ancient times), and this was ultimately named for the kobold.
Today, some cobalt is produced specifically from one of a number of metallic-lustered ores, such as cobaltite (CoAsS). The element is, however, more usually produced as a by-product of copper and nickel mining. The Copperbelt in the Democratic Republic of the Congo (DRC) and Zambia yields most of the global cobalt production. World production in 2016 was 116,000 tonnes (114,000 long tons; 128,000 short tons) (according to Natural Resources Canada), and the DRC alone accounted for more than 50%.[5]
Cobalt is primarily used in lithium-ion batteries, and in the manufacture of magnetic, wear-resistant and high-strength alloys. The compounds cobalt silicate and cobalt(II) aluminate (CoAl2O4, cobalt blue) give a distinctive deep blue color to glass, ceramics, inks, paints and varnishes. Cobalt occurs naturally as only one stable isotope, cobalt-59. Cobalt-60 is a commercially important radioisotope, used as a radioactive tracer and for the production of high-energy gamma rays.
Cobalt is the active center of a group of coenzymes called cobalamins. Vitamin B12, the best-known example of the type, is an essential vitamin for all animals. Cobalt in inorganic form is also a micronutrient for bacteria, algae, and fungi.
Characteristics[edit]

A block of electrolytically refined cobalt (99.9% purity) cut from a large plate
Cobalt is a ferromagnetic metal with a specific gravity of 8.9. The Curie temperature is 1,115 °C (2,039 °F)[6] and the magnetic moment is 1.6–1.7 Bohr magnetons per atom.[7] Cobalt has a relative permeability two-thirds that of iron.[8] Metallic cobalt occurs as two crystallographic structures: hcp and fcc. The ideal transition temperature between the hcp and fcc structures is 450 °C (842 °F), but in practice the energy difference between them is so small that random intergrowth of the two is common.[9][10][11]
Cobalt is a weakly reducing metal that is protected from oxidation by a passivating oxide film. It is attacked by halogens and sulfur. Heating in oxygen produces Co3O4 which loses oxygen at 900 °C (1,650 °F) to give the monoxide CoO.[12] The metal reacts with fluorine (F2) at 520 K to give CoF3; with chlorine (Cl2), bromine (Br2) and iodine (I2), producing equivalent binary halides. It does not react with hydrogen gas (H2) or nitrogen gas (N2) even when heated, but it does react with boron, carbon, phosphorus, arsenic and sulfur.[13] At ordinary temperatures, it reacts slowly with mineral acids, and very slowly with moist, but not with dry, air.[citation needed]
Compounds[edit]
Common oxidation states of cobalt include +2 and +3, although compounds with oxidation states ranging from −3 to +5 are also known. A common oxidation state for simple compounds is +2 (cobalt(II)). These salts form the pink-colored metal aquo complex [Co(H
2O)
6]2+
in water. Addition of chloride gives the intensely blue [CoCl
4]2−
.[3] In a borax bead flame test, cobalt shows deep blue in both oxidizing and reducing flames.[14]
Oxygen and chalcogen compounds[edit]
Several oxides of cobalt are known. Green cobalt(II) oxide (CoO) has rocksalt structure. It is readily oxidized with water and oxygen to brown cobalt(III) hydroxide (Co(OH)3). At temperatures of 600–700 °C, CoO oxidizes to the blue cobalt(II,III) oxide (Co3O4), which has a spinel structure.[3] Black cobalt(III) oxide (Co2O3) is also known.[15] Cobalt oxides are antiferromagnetic at low temperature: CoO (Néel temperature 291 K) and Co3O4 (Néel temperature: 40 K), which is analogous to magnetite (Fe3O4), with a mixture of +2 and +3 oxidation states.[16]
The principal chalcogenides of cobalt include the black cobalt(II) sulfides, CoS2, which adopts a pyrite-like structure, and cobalt(III) sulfide (Co2S3).[citation needed]
Halides[edit]

Cobalt(II) chloride hexahydrate
Four dihalides of cobalt(II) are known: cobalt(II) fluoride (CoF2, pink), cobalt(II) chloride (CoCl2, blue), cobalt(II) bromide (CoBr2, green), cobalt(II) iodide (CoI2, blue-black). These halides exist in anhydrous and hydrated forms. Whereas the anhydrous dichloride is blue, the hydrate is red.[17]
The reduction potential for the reaction Co3+
+ e− → Co2+
is +1.92 V, beyond that for chlorine to chloride, +1.36 V. Consequently, cobalt(III) chloride would spontaneously reduce to cobalt(II) chloride and chlorine. Because the reduction potential for fluorine to fluoride is so high, +2.87 V, cobalt(III) fluoride is one of the few simple stable cobalt(III) compounds. Cobalt(III) fluoride, which is used in some fluorination reactions, reacts vigorously with water.[12]
Coordination compounds[edit]
As for all metals, molecular compounds and polyatomic ions of cobalt are classified as coordination complexes, that is, molecules or ions that contain cobalt linked to one or more ligands. These can be combinations of a potentially infinite variety of molecules and ions, such as:
- water H
2O, as in the cation hexaaquocobalt(II) [Co(H
2O)
6]2+
. This pink-colored complex is the predominant cation in solid cobalt sulfate CoSO
4·(H
2O)x, with x = 6 or 7, as well as in water solutions thereof. - ammonia NH
3, as in cis-diaquotetraamminecobalt(III) [Co(NH
3)
4(H
2O)
2]3+
, in hexol [Co(Co(NH
3)
4(HO)
2)
3]6−
, in [Co(NO
2)
4(NH
3)
2]−
(the anion of Erdmann’s salt),[18] and in [Co(NH
3)
5(CO
3)]−
.[18] - carbonate [CO
3]2−
, as in the green triscarbonatocobaltate(III) [Co(CO
3)
3]3−
anion.[19][18][20] - nitrite [NO
2]−
as in [Co(NO
2)
4(NH
3)
2]−
.[18] - hydroxide [HO]−
, as in hexol. - chloride [Cl]−
, as in tetrachloridocobaltate(II) CoCl
4]2−
. - bicarbonate [HCO
3]−
, as in [Co(CO
3)
2(HCO
3)(H
2O)]3−
.[18] - oxalate [C
2O
4]2−
, as in trisoxalatocobaltate(III) [Co(C
2O
4)3−
3].[18]
These attached groups affect the stability of oxidation states of the cobalt atoms, according to general principles of electronegativity and of the hardness–softness. For example, Co3+ complexes tend to have ammine ligands. Because phosphorus is softer than nitrogen, phosphine ligands tend to feature the softer Co2+ and Co+, an example being tris(triphenylphosphine)cobalt(I) chloride (P(C
6H
5)
3)
3CoCl). The more electronegative (and harder) oxide and fluoride can stabilize Co4+ and Co5+ derivatives, e.g. caesium hexafluorocobaltate(IV) (Cs2CoF6) and potassium percobaltate (K3CoO4).[12]
Alfred Werner, a Nobel-prize winning pioneer in coordination chemistry, worked with compounds of empirical formula [Co(NH
3)
6]3+
. One of the isomers determined was cobalt(III) hexammine chloride. This coordination complex, a typical Werner-type complex, consists of a central cobalt atom coordinated by six ammine orthogonal ligands and three chloride counteranions. Using chelating ethylenediamine ligands in place of ammonia gives tris(ethylenediamine)cobalt(III) ([Co(en)
3]3+
), which was one of the first coordination complexes to be resolved into optical isomers. The complex exists in the right- and left-handed forms of a «three-bladed propeller». This complex was first isolated by Werner as yellow-gold needle-like crystals.[21][22]
Organometallic compounds[edit]
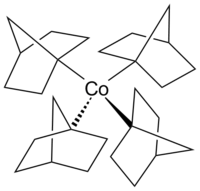
Structure of tetrakis(1-norbornyl)cobalt(IV)
Cobaltocene is a structural analog to ferrocene, with cobalt in place of iron. Cobaltocene is much more sensitive to oxidation than ferrocene.[23] Cobalt carbonyl (Co2(CO)8) is a catalyst in carbonylation and hydrosilylation reactions.[24] Vitamin B12 (see below) is an organometallic compound found in nature and is the only vitamin that contains a metal atom.[25] An example of an alkylcobalt complex in the otherwise uncommon +4 oxidation state of cobalt is the homoleptic complex tetrakis(1-norbornyl)cobalt(IV) (Co(1-norb)4), a transition metal-alkyl complex that is notable for its resistance to β-hydrogen elimination,[26] in accord with Bredt’s rule. The cobalt(III) and cobalt(V) complexes [Li(THF)
4]+
[Co(1-norb)
4]−
and [Co(1-norb)
4]+
[BF
4]−
are also known.[27]
Isotopes[edit]
59Co is the only stable cobalt isotope and the only isotope that exists naturally on Earth. Twenty-two radioisotopes have been characterized: the most stable, 60Co, has a half-life of 5.2714 years; 57Co has a half-life of 271.8 days; 56Co has a half-life of 77.27 days; and 58Co has a half-life of 70.86 days. All the other radioactive isotopes of cobalt have half-lives shorter than 18 hours, and in most cases shorter than 1 second. This element also has 4 meta states, all of which have half-lives shorter than 15 minutes.[28]
The isotopes of cobalt range in atomic weight from 50 u (50Co) to 73 u (73Co). The primary decay mode for isotopes with atomic mass unit values less than that of the only stable isotope, 59Co, is electron capture and the primary mode of decay in isotopes with atomic mass greater than 59 atomic mass units is beta decay. The primary decay products below 59Co are element 26 (iron) isotopes; above that the decay products are element 28 (nickel) isotopes.[28]
History[edit]

Early Chinese blue and white porcelain, manufactured c. 1335
Cobalt compounds have been used for centuries to impart a rich blue color to glass, glazes, and ceramics. Cobalt has been detected in Egyptian sculpture, Persian jewelry from the third millennium BC, in the ruins of Pompeii, destroyed in 79 AD, and in China, dating from the Tang dynasty (618–907 AD) and the Ming dynasty (1368–1644 AD).[29]
Cobalt has been used to color glass since the Bronze Age. The excavation of the Uluburun shipwreck yielded an ingot of blue glass, cast during the 14th century BC.[30][31] Blue glass from Egypt was either colored with copper, iron, or cobalt. The oldest cobalt-colored glass is from the eighteenth dynasty of Egypt (1550–1292 BC). The source for the cobalt the Egyptians used is not known.[32][33]
The word cobalt is derived from the German kobalt, from kobold meaning «goblin», a superstitious term used for the ore of cobalt by miners. The first attempts to smelt those ores for copper or silver failed, yielding simply powder (cobalt(II) oxide) instead. Because the primary ores of cobalt always contain arsenic, smelting the ore oxidized the arsenic into the highly toxic and volatile arsenic oxide, adding to the notoriety of the ore.[34]
Swedish chemist Georg Brandt (1694–1768) is credited with discovering cobalt circa 1735, showing it to be a previously unknown element, distinct from bismuth and other traditional metals. Brandt called it a new «semi-metal».[35][36] He showed that compounds of cobalt metal were the source of the blue color in glass, which previously had been attributed to the bismuth found with cobalt. Cobalt became the first metal to be discovered since the pre-historical period. All other known metals (iron, copper, silver, gold, zinc, mercury, tin, lead and bismuth) had no recorded discoverers.[37]
During the 19th century, a significant part of the world’s production of cobalt blue (a pigment made with cobalt compounds and alumina) and smalt (cobalt glass powdered for use for pigment purposes in ceramics and painting) was carried out at the Norwegian Blaafarveværket.[38][39] The first mines for the production of smalt in the 16th century were located in Norway, Sweden, Saxony and Hungary. With the discovery of cobalt ore in New Caledonia in 1864, the mining of cobalt in Europe declined. With the discovery of ore deposits in Ontario, Canada in 1904 and the discovery of even larger deposits in the Katanga Province in the Congo in 1914, the mining operations shifted again.[34] When the Shaba conflict started in 1978, the copper mines of Katanga Province nearly stopped production.[40][41] The impact on the world cobalt economy from this conflict was smaller than expected: cobalt is a rare metal, the pigment is highly toxic, and the industry had already established effective ways for recycling cobalt materials. In some cases, industry was able to change to cobalt-free alternatives.[40][41]
In 1938, John Livingood and Glenn T. Seaborg discovered the radioisotope cobalt-60.[42] This isotope was famously used at Columbia University in the 1950s to establish parity violation in radioactive beta decay.[43][44]
After World War II, the US wanted to guarantee the supply of cobalt ore for military uses (as the Germans had been doing) and prospected for cobalt within the U.S. border. An adequate supply of the ore was found in Idaho near Blackbird canyon in the side of a mountain. The firm Calera Mining Company started production at the site.[45]
It has been argued that cobalt will be one of the main objects of geopolitical competition in a world running on renewable energy and dependent on batteries, but this perspective has also been criticised for underestimating the power of economic incentives for expanded production.[46]
Occurrence[edit]
The stable form of cobalt is produced in supernovae through the r-process.[47] It comprises 0.0029% of the Earth’s crust. Free cobalt (the native metal) is not found on Earth because of the oxygen in the atmosphere and the chlorine in the ocean. Both are abundant enough in the upper layers of the Earth’s crust to prevent native metal cobalt from forming. Except as recently delivered in meteoric iron, pure cobalt in native metal form is unknown on Earth. The element has a medium abundance but natural compounds of cobalt are numerous and small amounts of cobalt compounds are found in most rocks, soils, plants, and animals.[citation needed]
In nature, cobalt is frequently associated with nickel. Both are characteristic components of meteoric iron, though cobalt is much less abundant in iron meteorites than nickel. As with nickel, cobalt in meteoric iron alloys may have been well enough protected from oxygen and moisture to remain as the free (but alloyed) metal,[48] though neither element is seen in that form in the ancient terrestrial crust.[citation needed]
Cobalt in compound form occurs in copper and nickel minerals. It is the major metallic component that combines with sulfur and arsenic in the sulfidic cobaltite (CoAsS), safflorite (CoAs2), glaucodot ((Co,Fe)AsS), and skutterudite (CoAs3) minerals.[12] The mineral cattierite is similar to pyrite and occurs together with vaesite in the copper deposits of Katanga Province.[49] When it reaches the atmosphere, weathering occurs; the sulfide minerals oxidize and form pink erythrite («cobalt glance»: Co3(AsO4)2·8H2O) and spherocobaltite (CoCO3).[50][51]
Cobalt is also a constituent of tobacco smoke.[52] The tobacco plant readily absorbs and accumulates heavy metals like cobalt from the surrounding soil in its leaves. These are subsequently inhaled during tobacco smoking.[53]
In the ocean[edit]
Cobalt is a trace metal involved in photosynthesis and nitrogen fixation detected in most ocean basins and is a limiting micronutrient for phytoplankton and cyanobacteria.[54][55] The Co-containing complex cobalamin is only synthesized by cyanobacteria and a few archaea, so dissolved cobalt concentrations are low in the upper ocean. Like Mn and Fe, Co has a hybrid profile of biological uptake by phytoplankton via photosynthesis in the upper ocean and scavenging in the deep ocean, although most scavenging is limited by complex organic ligands.[56][57] Co is recycled in the ocean by decaying organic matter that sinks below the upper ocean, although most is scavenged by oxidizing bacteria.[citation needed]
Sources of cobalt for many ocean bodies include rivers and terrestrial runoff with some input from hydrothermal vents.[58] In the deep ocean, cobalt sources are found lying on top of seamounts (which can be large or small) where ocean currents sweep the ocean floor to clear sediment over the span of millions of years allowing them to form as ferromanganese crusts.[59] Although limited mapping of the seafloor has been done, preliminary investigation indicates that there is a large amount of these cobalt-rich crusts located in the Clarion Clipperton Zone,[60] an area garnering increasing interest for deep sea mining ventures due to the mineral-rich environment within its domain. Anthropogenic input contributes as a non-natural source but in very low amounts. Dissolved cobalt (dCo) concentrations across oceans are controlled primarily by reservoirs where dissolved oxygen concentrations are low. The complex biochemical cycling of cobalt in the ocean is still not fully understood, but patterns of higher concentrations have been found in areas of low oxygen[61] such as the Oxygen Minimum Zone (OMZ) in the Southern Atlantic Ocean.[62]
Cobalt is considered toxic for marine environments at high concentrations.[63] Safe concentrations fall around 18 μg/L in marine waters for plankton such as diatoms.[citation needed]
Production[edit]

| Country | Production | Reserves |
|---|---|---|
| 64,000 | 3,500,000 | |
| 5,600 | 250,000 | |
| 5,000 | 1,200,000 | |
| 4,300 | 250,000 | |
| 4,200 | 500,000 | |
| 4,000 | 280,000 | |
| 3,800 | 150,000 | |
| 3,200 | 51,000 | |
| 2,900 | 270,000 | |
| 2,800 | — | |
| 2,500 | 29,000 | |
| 1,500 | ||
| 650 | 23,000 | |
| Other countries | 5,900 | 560,000 |
| World total | 110,000 | 7,100,000 |
The main ores of cobalt are cobaltite, erythrite, glaucodot and skutterudite (see above), but most cobalt is obtained by reducing the cobalt by-products of nickel and copper mining and smelting.[65][66]
Since cobalt is generally produced as a by-product, the supply of cobalt depends to a great extent on the economic feasibility of copper and nickel mining in a given market. Demand for cobalt was projected to grow 6% in 2017.[67]
Primary cobalt deposits are rare, such as those occurring in hydrothermal deposits, associated with ultramafic rocks, typified by the Bou-Azzer district of Morocco. At such locations, cobalt ores are mined exclusively, albeit at a lower concentration, and thus require more downstream processing for cobalt extraction.[68][69]
Several methods exist to separate cobalt from copper and nickel, depending on the concentration of cobalt and the exact composition of the used ore. One method is froth flotation, in which surfactants bind to ore components, leading to an enrichment of cobalt ores. Subsequent roasting converts the ores to cobalt sulfate, and the copper and the iron are oxidized to the oxide. Leaching with water extracts the sulfate together with the arsenates. The residues are further leached with sulfuric acid, yielding a solution of copper sulfate. Cobalt can also be leached from the slag of copper smelting.[70]
The products of the above-mentioned processes are transformed into the cobalt oxide (Co3O4). This oxide is reduced to metal by the aluminothermic reaction or reduction with carbon in a blast furnace.[12]

[edit]
The United States Geological Survey estimates world reserves of cobalt at 7,100,000 metric tons.[71] The Democratic Republic of the Congo (DRC) currently produces 63% of the world’s cobalt. This market share may reach 73% by 2025 if planned expansions by mining producers like Glencore Plc take place as expected. But by 2030, global demand could be 47 times more than it was in 2017, Bloomberg New Energy Finance has estimated.[72]
Changes that Congo made to mining laws in 2002 attracted new investments in Congolese copper and cobalt projects. Glencore’s Mutanda Mine shipped 24,500 tons of cobalt in 2016, 40% of Congo DRC’s output and nearly a quarter of global production. After oversupply, Glencore closed Mutanda for two years in late 2019.[73][74] Glencore’s Katanga Mining project is resuming as well and should produce 300,000 tons of copper and 20,000 tons of cobalt by 2019, according to Glencore.[67]

After hitting near-decade highs in early 2018 above US$100,000 per tonne, prices for cobalt used in the global electric battery supply chain slipped by 45% in the following 2 years. With the upsurge in Electric (EV) vehicle demand in 2020 and early 2021, cobalt prices rose to US$54,000 per tonne by March 2021.[citation needed]
Cobalt is ranked as a critical mineral by the United States, Japan, Republic of Korea, the United Kingdom and the European Union.[citation needed]
Democratic Republic of the Congo[edit]
In 2005, the top producer of cobalt was the copper deposits in the Democratic Republic of the Congo’s Katanga Province. Formerly Shaba province, the area had almost 40% of global reserves, reported the British Geological Survey in 2009.[75]
Artisanal mining supplied 17% to 40% of the DRC production.[76] Some 100,000 cobalt miners in Congo DRC use hand tools to dig hundreds of feet, with little planning and fewer safety measures, say workers and government and NGO officials, as well as The Washington Post reporters’ observations on visits to isolated mines. The lack of safety precautions frequently causes injuries or death.[77] Mining pollutes the vicinity and exposes local wildlife and indigenous communities to toxic metals thought to cause birth defects and breathing difficulties, according to health officials.[78]
Human rights activists have alleged, and investigative journalism reported confirmation,[79][80] that child labor is used in mining cobalt from African artisanal mines.[76][81] This revelation prompted cell phone maker Apple Inc., on March 3, 2017, to stop buying ore from suppliers such as Zhejiang Huayou Cobalt who source from artisanal mines in the DRC, and begin using only suppliers that are verified to meet its workplace standards.[82][83]
There is a push globally by the EU and major car manufacturers (OEM) for global production of cobalt to be sourced and produced sustainably, responsibly and traceability of the supply chain. Mining companies are adopting and practising ESG initiatives in line with OECD Guidance and putting in place evidence of zero to low carbon footprint activities in the supply chain production of Lithium-ion batteries. These initiatives are already taking place with major mining companies, Artisanal and Small-Scale Mining companies (ASM). Car manufacturers and battery manufacturer supply chains Tesla, VW, BMW, BASF, Glencore are participating in several initiatives, such as the Responsible Cobalt Initiative and Cobalt for Development study. In 2018 BMW Group in partnership with BASF, Samsung SDI and Samsung Electronics have launched a pilot project in the DRC over one pilot mine, to improve conditions and address challenges for artisanal miners and the surrounding communities.
The political and ethnic dynamics of the region have in the past caused outbreaks of violence and years of armed conflict and displaced populations. This instability affected the price of cobalt and also created perverse incentives for the combatants in the First and Second Congo Wars to prolong the fighting, since access to diamond mines and other valuable resources helped to finance their military goals—which frequently amounted to genocide—and also enriched the fighters themselves. While DR Congo has in the 2010s not recently been invaded by neighboring military forces, some of the richest mineral deposits adjoin areas where Tutsis and Hutus still frequently clash, unrest continues although on a smaller scale and refugees still flee outbreaks of violence.[84]
Cobalt extracted from small Congolese artisanal mining endeavors in 2007 supplied a single Chinese company, Congo DongFang International Mining. A subsidiary of Zhejiang Huayou Cobalt, one of the world’s largest cobalt producers, Congo DongFang supplied cobalt to some of the world’s largest battery manufacturers, who produced batteries for ubiquitous products like the Apple iPhones. Because of accused labour violations and environmental concerns, LG Chem subsequently audited Congo DongFang in accordance with OECD guidelines. LG Chem, which also produces battery materials for car companies, imposed a code of conduct on all suppliers that it inspects.[85]
The Mukondo Mountain project, operated by the Central African Mining and Exploration Company (CAMEC) in Katanga Province, may be the richest cobalt reserve in the world. It produced an estimated one-third of the total global cobalt production in 2008.[86] In July 2009, CAMEC announced a long-term agreement to deliver its entire annual production of cobalt concentrate from Mukondo Mountain to Zhejiang Galico Cobalt & Nickel Materials of China.[87]
In February 2018, global asset management firm AllianceBernstein defined the DRC as economically «the Saudi Arabia of the electric vehicle age», due to its cobalt resources, as essential to the lithium-ion batteries that drive electric vehicles.[88]
On March 9, 2018, President Joseph Kabila updated the 2002 mining code, increasing royalty charges and declaring cobalt and coltan «strategic metals».[89][90]
The 2002 mining code was effectively updated on December 4, 2018.[91]
In December 2019, International Rights Advocates, a human rights NGO, filed a landmark lawsuit against Apple, Tesla, Dell, Microsoft and Google company Alphabet for «knowingly benefiting from and aiding and abetting the cruel and brutal use of young children» in mining cobalt.[92] The companies in question denied their involvement in child labour.[93]
Canada[edit]
In 2017, some exploration companies were planning to survey old silver and cobalt mines in the area of Cobalt, Ontario where significant deposits are believed to lie.[94]
Cuba[edit]
Canada’s Sherritt International processes cobalt ores in nickel deposits from the Moa mines in Cuba, and the island has several others mines in Mayari, Camaguey, and Pinar del Rio. Continued investments by Sherritt International in Cuban nickel and cobalt production while acquiring mining rights for 17–20 years made the communist country third for cobalt reserves in 2019, before Canada itself.[95]
Applications[edit]
In 2016, 116,000 tonnes (128,000 short tons) of cobalt was used.[5]
Cobalt has been used in the production of high-performance alloys.[65][66] It is also used in some rechargeable batteries.
Alloys[edit]
Cobalt-based superalloys have historically consumed most of the cobalt produced.[65][66] The temperature stability of these alloys makes them suitable for turbine blades for gas turbines and aircraft jet engines, although nickel-based single-crystal alloys surpass them in performance.[96] Cobalt-based alloys are also corrosion- and wear-resistant, making them, like titanium, useful for making orthopedic implants that don’t wear down over time. The development of wear-resistant cobalt alloys started in the first decade of the 20th century with the stellite alloys, containing chromium with varying quantities of tungsten and carbon. Alloys with chromium and tungsten carbides are very hard and wear-resistant.[97] Special cobalt-chromium-molybdenum alloys like Vitallium are used for prosthetic parts (hip and knee replacements).[98] Cobalt alloys are also used for dental prosthetics as a useful substitute for nickel, which may be allergenic.[99] Some high-speed steels also contain cobalt for increased heat and wear resistance. The special alloys of aluminium, nickel, cobalt and iron, known as Alnico, and of samarium and cobalt (samarium-cobalt magnet) are used in permanent magnets.[100] It is also alloyed with 95% platinum for jewelry, yielding an alloy suitable for fine casting, which is also slightly magnetic.[101]
Batteries[edit]
Lithium cobalt oxide (LiCoO2) is widely used in lithium-ion battery cathodes. The material is composed of cobalt oxide layers with the lithium intercalated. During discharge (i.e. when not actively being charged), the lithium is released as lithium ions.[102] Nickel-cadmium[103] (NiCd) and nickel metal hydride[104] (NiMH) batteries also include cobalt to improve the oxidation of nickel in the battery.[103]
Transparency Market Research estimated the global lithium-ion battery market at $30 billion in 2015 and predicted an increase to over US$75 billion by 2024.[105]
Although in 2018 most cobalt in batteries was used in a mobile device,[106] a more recent application for cobalt is rechargeable batteries for electric cars. This industry has increased five-fold in its demand for cobalt, which makes it urgent to find new raw materials in more stable areas of the world.[107] Demand is expected to continue or increase as the prevalence of electric vehicles increases.[108] Exploration in 2016–2017 included the area around Cobalt, Ontario, an area where many silver mines ceased operation decades ago.[107] Cobalt for electric vehicles increased 81% from the first half of 2018 to 7,200 tonnes in the first half of 2019, for a battery capacity of 46.3 GWh.[109][110] The future of electric cars may depend on deep-sea mining, since cobalt is abundant in rocks on the seabed.[111]
Since child and slave labor have been repeatedly reported in cobalt mining, primarily in the artisanal mines of DR Congo, technology companies seeking an ethical supply chain have faced shortages of this raw material and[112] the price of cobalt metal reached a nine-year high in October 2017, more than US$30 a pound, versus US$10 in late 2015.[113] After oversupply, the price dropped to a more normal $15 in 2019.[114][115] As a reaction to the issues with artisanal cobalt mining in DR Congo a number of cobalt suppliers and their customers have formed the Fair Cobalt Alliance (FCA) which aims to end the use of child labor and to improve the working conditions of cobalt mining and processing in the DR Congo. Members of FCA include Zhejiang Huayou Cobalt, Sono Motors, the Responsible Cobalt Initiative, Fairphone, Glencore and Tesla, Inc.[116][117]
Research is being conducted by the European Union on the possibility to eliminate cobalt requirements in lithium-ion battery production.[118][119] As of August 2020 battery makers have gradually reduced the cathode cobalt content from 1/3 (NMC 111) to 2/10 (NMC 442) to currently 1/10 (NMC 811) and have also introduced the cobalt free LFP cathode into the battery packs of electric cars such as the Tesla Model 3.[120][121] In September 2020, Tesla outlined their plans to make their own, cobalt-free battery cells.[122]
Catalysts[edit]
Several cobalt compounds are oxidation catalysts. Cobalt acetate is used to convert xylene to terephthalic acid, the precursor of the bulk polymer polyethylene terephthalate. Typical catalysts are the cobalt carboxylates (known as cobalt soaps). They are also used in paints, varnishes, and inks as «drying agents» through the oxidation of drying oils.[123][102] The same carboxylates are used to improve the adhesion between steel and rubber in steel-belted radial tires. In addition they are used as accelerators in polyester resin systems.[124][125][126]
Cobalt-based catalysts are used in reactions involving carbon monoxide. Cobalt is also a catalyst in the Fischer–Tropsch process for the hydrogenation of carbon monoxide into liquid fuels.[127] Hydroformylation of alkenes often uses cobalt octacarbonyl as a catalyst,[128]
The hydrodesulfurization of petroleum uses a catalyst derived from cobalt and molybdenum. This process helps to clean petroleum of sulfur impurities that interfere with the refining of liquid fuels.[102]
Pigments and coloring[edit]


Before the 19th century, cobalt was predominantly used as a pigment. It has been used since the Middle Ages to make smalt, a blue-colored glass. Smalt is produced by melting a mixture of roasted mineral smaltite, quartz and potassium carbonate, which yields a dark blue silicate glass, which is finely ground after the production.[129] Smalt was widely used to color glass and as pigment for paintings.[130] In 1780, Sven Rinman discovered cobalt green, and in 1802 Louis Jacques Thénard discovered cobalt blue.[131] Cobalt pigments such as cobalt blue (cobalt aluminate), cerulean blue (cobalt(II) stannate), various hues of cobalt green (a mixture of cobalt(II) oxide and zinc oxide), and cobalt violet (cobalt phosphate) are used as artist’s pigments because of their superior chromatic stability.[132][133]
Radioisotopes[edit]
Cobalt-60 (Co-60 or 60Co) is useful as a gamma-ray source because it can be produced in predictable amounts with high activity by bombarding cobalt with neutrons. It produces gamma rays with energies of 1.17 and 1.33 MeV.[28][134]
Cobalt is used in external beam radiotherapy, sterilization of medical supplies and medical waste, radiation treatment of foods for sterilization (cold pasteurization),[135] industrial radiography (e.g. weld integrity radiographs), density measurements (e.g. concrete density measurements), and tank fill height switches. The metal has the unfortunate property of producing a fine dust, causing problems with radiation protection. Cobalt from radiotherapy machines has been a serious hazard when not discarded properly, and one of the worst radiation contamination accidents in North America occurred in 1984, when a discarded radiotherapy unit containing cobalt-60 was mistakenly disassembled in a junkyard in Juarez, Mexico.[136][137]
Cobalt-60 has a radioactive half-life of 5.27 years. Loss of potency requires periodic replacement of the source in radiotherapy and is one reason why cobalt machines have been largely replaced by linear accelerators in modern radiation therapy.[138] Cobalt-57 (Co-57 or 57Co) is a cobalt radioisotope most often used in medical tests, as a radiolabel for vitamin B12 uptake, and for the Schilling test. Cobalt-57 is used as a source in Mössbauer spectroscopy and is one of several possible sources in X-ray fluorescence devices.[139][140]
Nuclear weapon designs could intentionally incorporate 59Co, some of which would be activated in a nuclear explosion to produce 60Co. The 60Co, dispersed as nuclear fallout, is sometimes called a cobalt bomb.[141]
[142]
Other uses[edit]
- Cobalt is used in electroplating for its attractive appearance, hardness, and resistance to oxidation.[143]
- It is also used as a base primer coat for porcelain enamels.[144]
Biological role[edit]
Cobalt is essential to the metabolism of all animals. It is a key constituent of cobalamin, also known as vitamin B12, the primary biological reservoir of cobalt as an ultratrace element.[145][146] Bacteria in the stomachs of ruminant animals convert cobalt salts into vitamin B12, a compound which can only be produced by bacteria or archaea. A minimal presence of cobalt in soils therefore markedly improves the health of grazing animals, and an uptake of 0.20 mg/kg a day is recommended because they have no other source of vitamin B12.[147]
Proteins based on cobalamin use corrin to hold the cobalt. Coenzyme B12 features a reactive C-Co bond that participates in the reactions.[148] In humans, B12 has two types of alkyl ligand: methyl and adenosyl. MeB12 promotes methyl (−CH3) group transfers. The adenosyl version of B12 catalyzes rearrangements in which a hydrogen atom is directly transferred between two adjacent atoms with concomitant exchange of the second substituent, X, which may be a carbon atom with substituents, an oxygen atom of an alcohol, or an amine. Methylmalonyl coenzyme A mutase (MUT) converts MMl-CoA to Su-CoA, an important step in the extraction of energy from proteins and fats.[149]
Although far less common than other metalloproteins (e.g. those of zinc and iron), other cobaltoproteins are known besides B12. These proteins include methionine aminopeptidase 2, an enzyme that occurs in humans and other mammals that does not use the corrin ring of B12, but binds cobalt directly. Another non-corrin cobalt enzyme is nitrile hydratase, an enzyme in bacteria that metabolizes nitriles.[150]
Cobalt deficiency[edit]
In humans, consumption of cobalt-containing vitamin B12 meets all needs for cobalt. For cattle and sheep, which meet vitamin B12 needs via synthesis by resident bacteria in the rumen, there is a function for inorganic cobalt. In the early 20th century, during the development of farming on the North Island Volcanic Plateau of New Zealand, cattle suffered from what was termed «bush sickness». It was discovered that the volcanic soils lacked the cobalt salts essential for the cattle food chain.[151][152] The «coast disease» of sheep in the Ninety Mile Desert of the Southeast of South Australia in the 1930s was found to originate in nutritional deficiencies of trace elements cobalt and copper. The cobalt deficiency was overcome by the development of «cobalt bullets», dense pellets of cobalt oxide mixed with clay given orally for lodging in the animal’s rumen.[clarification needed][153][152][154]
-
-

Cobalt-deficient sheep
Health issues[edit]
| Hazards | |
|---|---|
| GHS labelling:[155] | |
| Pictograms |   |
| Signal word | Danger |
| Hazard statements | H302, H317, H319, H334, H341, H350, H360F, H412 |
| Precautionary statements | P273, P280, P301+P312, P302+P352, P305+P351+P338, P308+P313 |
| NFPA 704 (fire diamond) |
2 0 0 |
The LD50 value for soluble cobalt salts has been estimated to be between 150 and 500 mg/kg.[156] In the US, the Occupational Safety and Health Administration (OSHA) has designated a permissible exposure limit (PEL) in the workplace as a time-weighted average (TWA) of 0.1 mg/m3. The National Institute for Occupational Safety and Health (NIOSH) has set a recommended exposure limit (REL) of 0.05 mg/m3, time-weighted average. The IDLH (immediately dangerous to life and health) value is 20 mg/m3.[157]
However, chronic cobalt ingestion has caused serious health problems at doses far less than the lethal dose. In 1966, the addition of cobalt compounds to stabilize beer foam in Canada led to a peculiar form of toxin-induced cardiomyopathy, which came to be known as beer drinker’s cardiomyopathy.[158][159]
Furthermore, cobalt metal is suspected of causing cancer (i.e., possibly carcinogenic, IARC Group 2B) as per the International Agency for Research on Cancer (IARC) Monographs.[160]
It causes respiratory problems when inhaled.[161] It also causes skin problems when touched; after nickel and chromium, cobalt is a major cause of contact dermatitis.[162]
References[edit]
- ^ «cobalt». Oxford English Dictionary (2nd ed.). Oxford University Press. 1989.
- ^ «Standard Atomic Weights: Cobalt». CIAAW. 2017.
- ^ a b c Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. pp. 1117–1119. ISBN 978-0-08-037941-8.
- ^ «cobalt». Oxford English Dictionary (2nd ed.). Oxford University Press. 1989.
- ^ a b Danielle Bochove (November 1, 2017). «Electric car future spurs Cobalt rush: Swelling demand for product breathes new life into small Ontario town». Vancouver Sun. Bloomberg. Archived from the original on 2019-07-28.
- ^ Enghag, Per (2004). «Cobalt». Encyclopedia of the elements: technical data, history, processing, applications. p. 667. ISBN 978-3-527-30666-4.
- ^ Murthy, V. S. R (2003). «Magnetic Properties of Materials». Structure And Properties Of Engineering Materials. p. 381. ISBN 978-0-07-048287-6.
- ^ Celozzi, Salvatore; Araneo, Rodolfo; Lovat, Giampiero (2008-05-01). Electromagnetic Shielding. p. 27. ISBN 978-0-470-05536-6.
- ^ Lee, B.; Alsenz, R.; Ignatiev, A.; Van Hove, M.; Van Hove, M. A. (1978). «Surface structures of the two allotropic phases of cobalt». Physical Review B. 17 (4): 1510–1520. Bibcode:1978PhRvB..17.1510L. doi:10.1103/PhysRevB.17.1510.
- ^ «Properties and Facts for Cobalt». American Elements. Archived from the original on 2008-10-02. Retrieved 2008-09-19.
- ^ Cobalt, Centre d’Information du Cobalt, Brussels (1966). Cobalt. p. 45.
{{cite book}}: CS1 maint: multiple names: authors list (link) - ^ a b c d e Holleman, A. F.; Wiberg, E.; Wiberg, N. (2007). «Cobalt». Lehrbuch der Anorganischen Chemie (in German) (102nd ed.). de Gruyter. pp. 1146–1152. ISBN 978-3-11-017770-1.
- ^ Housecroft, C. E.; Sharpe, A. G. (2008). Inorganic Chemistry (3rd ed.). Prentice Hall. p. 722. ISBN 978-0-13-175553-6.
- ^ Rutley, Frank (2012-12-06). Rutley’s Elements of Mineralogy. Springer Science & Business Media. p. 40. ISBN 978-94-011-9769-4.
- ^ Krebs, Robert E. (2006). The history and use of our earth’s chemical elements: a reference guide (2nd ed.). Greenwood Publishing Group. p. 107. ISBN 0-313-33438-2.
- ^ Petitto, Sarah C.; Marsh, Erin M.; Carson, Gregory A.; Langell, Marjorie A. (2008). «Cobalt oxide surface chemistry: The interaction of CoO(100), Co3O4(110) and Co3O4(111) with oxygen and water». Journal of Molecular Catalysis A: Chemical. 281 (1–2): 49–58. doi:10.1016/j.molcata.2007.08.023. S2CID 28393408.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. pp. 1119–1120. ISBN 978-0-08-037941-8.
- ^ a b c d e f Thomas P. McCutcheon and William J. Schuele (1953): «Complex Acids of Cobalt and Chromium. The Green Carbonatocobalt(III) Anion». Journal of the American Chemical Society, volume 75, issue 8, pages 1845–1846. doi:10.1021/ja01104a019
- ^ H. F. Bauer and W. C. Drinkard (1960): «A General Synthesis of Cobalt(III) Complexes; A New Intermediate, Na3[Co(CO3)3]·3H2O». Journal of the American Chemical Society, volume 82, issue 19, pages 5031–5032. doi:10.1021/ja01504a004.
- ^ Fikru Tafesse, Elias Aphane, and Elizabeth Mongadi (2009): «Determination of the structural formula of sodium tris-carbonatocobaltate(III), Na3[Co(CO3)3]·3H2O by thermogravimetry». Journal of Thermal Analysis and Calorimetry, volume 102, issue 1, pages 91–97. doi:10.1007/s10973-009-0606-2
- ^ Werner, A. (1912). «Zur Kenntnis des asymmetrischen Kobaltatoms. V». Chemische Berichte. 45: 121–130. doi:10.1002/cber.19120450116.
- ^ Gispert, Joan Ribas (2008). «Early Theories of Coordination Chemistry». Coordination chemistry. pp. 31–33. ISBN 978-3-527-31802-5. Archived from the original on 2016-05-05. Retrieved 2015-06-27.
- ^
James E. House (2008). Inorganic chemistry. Academic Press. pp. 767–. ISBN 978-0-12-356786-4. Retrieved 2011-05-16. - ^ Charles M. Starks; Charles Leonard Liotta; Marc Halpern (1994). Phase-transfer catalysis: fundamentals, applications, and industrial perspectives. Springer. pp. 600–. ISBN 978-0-412-04071-9. Retrieved 2011-05-16.
- ^ Sigel, Astrid; Sigel, Helmut; Sigel, Roland, eds. (2010). Organometallics in Environment and Toxicology (Metal Ions in Life Sciences). Cambridge, UK: Royal Society of Chemistry Publishing. p. 75. ISBN 978-1-84755-177-1.
- ^
Byrne, Erin K.; Richeson, Darrin S.; Theopold, Klaus H. (1986-01-01). «Tetrakis(1-norbornyl)cobalt, a low spin tetrahedral complex of a first row transition metal». Journal of the Chemical Society, Chemical Communications (19): 1491. doi:10.1039/C39860001491. ISSN 0022-4936. - ^
Byrne, Erin K.; Theopold, Klaus H. (1987-02-01). «Redox chemistry of tetrakis(1-norbornyl)cobalt. Synthesis and characterization of a cobalt(V) alkyl and self-exchange rate of a Co(III)/Co(IV) couple». Journal of the American Chemical Society. 109 (4): 1282–1283. doi:10.1021/ja00238a066. ISSN 0002-7863. - ^ a b c Audi, Georges; Bersillon, Olivier; Blachot, Jean; Wapstra, Aaldert Hendrik (2003), «The NUBASE evaluation of nuclear and decay properties», Nuclear Physics A, 729: 3–128, Bibcode:2003NuPhA.729….3A, doi:10.1016/j.nuclphysa.2003.11.001
- ^ Cobalt, Encyclopædia Britannica Online.
- ^
Pulak, Cemal (1998). «The Uluburun shipwreck: an overview». International Journal of Nautical Archaeology. 27 (3): 188–224. doi:10.1111/j.1095-9270.1998.tb00803.x. - ^
Henderson, Julian (2000). «Glass». The Science and Archaeology of Materials: An Investigation of Inorganic Materials. Routledge. p. 60. ISBN 978-0-415-19933-9. - ^
Rehren, Th. (2003). «Aspects of the Production of Cobalt-blue Glass in Egypt». Archaeometry. 43 (4): 483–489. doi:10.1111/1475-4754.00031. - ^ Lucas, A. (2003). Ancient Egyptian Materials and Industries. Kessinger Publishing. p. 217. ISBN 978-0-7661-5141-3.
- ^ a b Dennis, W. H (2010). «Cobalt». Metallurgy: 1863–1963. pp. 254–256. ISBN 978-0-202-36361-5.
- ^ Georg Brandt first showed cobalt to be a new metal in: G. Brandt (1735) «Dissertatio de semimetallis» (Dissertation on semi-metals), Acta Literaria et Scientiarum Sveciae (Journal of Swedish literature and sciences), vol. 4, pages 1–10.
See also: (1) G. Brandt (1746) «Rön och anmärkningar angäende en synnerlig färg—cobolt» (Observations and remarks concerning an extraordinary pigment—cobalt), Kongliga Svenska vetenskapsakademiens handlingar (Transactions of the Royal Swedish Academy of Science), vol. 7, pp. 119–130; (2) G. Brandt (1748) «Cobalti nova species examinata et descripta» (Cobalt, a new element examined and described), Acta Regiae Societatis Scientiarum Upsaliensis (Journal of the Royal Scientific Society of Uppsala), 1st series, vol. 3, pp. 33–41; (3) James L. Marshall and Virginia R. Marshall (Spring 2003) «Rediscovery of the Elements: Riddarhyttan, Sweden». The Hexagon (official journal of the Alpha Chi Sigma fraternity of chemists), vol. 94, no. 1, pages 3–8. - ^
Wang, Shijie (2006). «Cobalt—Its recovery, recycling, and application». Journal of the Minerals, Metals and Materials Society. 58 (10): 47–50. Bibcode:2006JOM….58j..47W. doi:10.1007/s11837-006-0201-y. S2CID 137613322. - ^ Weeks, Mary Elvira (1932). «The discovery of the elements. III. Some eighteenth-century metals». Journal of Chemical Education. 9 (1): 22. Bibcode:1932JChEd…9…22W. doi:10.1021/ed009p22.
- ^ Ramberg, Ivar B. (2008). The making of a land: geology of Norway. Geological Society. pp. 98–. ISBN 978-82-92394-42-7. Retrieved 2011-04-30.
- ^ Cyclopaedia (1852). C. Tomlinson. 9 divs (ed.). Cyclopædia of useful arts & manufactures. pp. 400–. Retrieved 2011-04-30.
- ^ a b Wellmer, Friedrich-Wilhelm; Becker-Platen, Jens Dieter. «Global Nonfuel Mineral Resources and Sustainability». United States Geological Survey.
- ^ a b Westing, Arthur H; Stockholm International Peace Research Institute (1986). «cobalt». Global resources and international conflict: environmental factors in strategic policy and action. pp. 75–78. ISBN 978-0-19-829104-6.
- ^ Livingood, J.; Seaborg, Glenn T. (1938). «Long-Lived Radio Cobalt Isotopes». Physical Review. 53 (10): 847–848. Bibcode:1938PhRv…53..847L. doi:10.1103/PhysRev.53.847.
- ^ Wu, C. S. (1957). «Experimental Test of Parity Conservation in Beta Decay». Physical Review. 105 (4): 1413–1415. Bibcode:1957PhRv..105.1413W. doi:10.1103/PhysRev.105.1413.
- ^ Wróblewski, A. K. (2008). «The Downfall of Parity – the Revolution That Happened Fifty Years Ago». Acta Physica Polonica B. 39 (2): 251. Bibcode:2008AcPPB..39..251W. S2CID 34854662.
- ^ «Richest Hole In The Mountain». Popular Mechanics: 65–69. 1952.
- ^ Overland, Indra (2019-03-01). «The geopolitics of renewable energy: Debunking four emerging myths». Energy Research & Social Science. 49: 36–40. doi:10.1016/j.erss.2018.10.018. ISSN 2214-6296.
- ^ Ptitsyn, D. A.; Chechetkin, V. M. (1980). «Creation of the Iron-Group Elements in a Supernova Explosion». Soviet Astronomy Letters. 6: 61–64. Bibcode:1980SvAL….6…61P.
- ^ Nuccio, Pasquale Mario and Valenza, Mariano (1979). «Determination of metallic iron, nickel and cobalt in meteorites» (PDF). Rendiconti Societa Italiana di Mineralogia e Petrografia. 35 (1): 355–360.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^
Kerr, Paul F. (1945). «Cattierite and Vaesite: New Co-Ni Minerals from the Belgian Kongo» (PDF). American Mineralogist. 30: 483–492. - ^ Buckley, A. N. (1987). «The Surface Oxidation of Cobaltite». Australian Journal of Chemistry. 40 (2): 231. doi:10.1071/CH9870231.
- ^ Young, R. (1957). «The geochemistry of cobalt». Geochimica et Cosmochimica Acta. 13 (1): 28–41. Bibcode:1957GeCoA..13…28Y. doi:10.1016/0016-7037(57)90056-X.
- ^
Talhout, Reinskje; Schulz, Thomas; Florek, Ewa; Van Benthem, Jan; Wester, Piet; Opperhuizen, Antoon (2011). «Hazardous Compounds in Tobacco Smok». International Journal of Environmental Research and Public Health. 8 (12): 613–628. doi:10.3390/ijerph8020613. ISSN 1660-4601. PMC 3084482. PMID 21556207. - ^
Pourkhabbaz, A; Pourkhabbaz, H (2012). «Investigation of Toxic Metals in the Tobacco of Different Iranian Cigarette Brands and Related Health Issues». Iranian Journal of Basic Medical Sciences. 15 (1): 636–644. PMC 3586865. PMID 23493960. - ^ Bundy, Randelle M.; Tagliabue, Alessandro; Hawco, Nicholas J.; Morton, Peter L.; Twining, Benjamin S.; Hatta, Mariko; Noble, Abigail E.; Cape, Mattias R.; John, Seth G.; Cullen, Jay T.; Saito, Mak A. (1 October 2020). «Elevated sources of cobalt in the Arctic Ocean». Biogeosciences. 17 (19): 4745–4767. Bibcode:2020BGeo…17.4745B. doi:10.5194/bg-17-4745-2020. Retrieved 24 November 2020.
- ^ Noble, Abigail E.; Lamborg, Carl H.; Ohnemus, Dan C.; Lam, Phoebe J.; Goepfert, Tyler J.; Measures, Chris I.; Frame, Caitlin H.; Casciotti, Karen L.; DiTullio, Giacomo R.; Jennings, Joe; Saito, Mak A. (2012). «Basin-scale inputs of cobalt, iron, and manganese from the Benguela-Angola front to the South Atlantic Ocean». Limnology and Oceanography. 57 (4): 989–1010. Bibcode:2012LimOc..57..989N. doi:10.4319/lo.2012.57.4.0989. ISSN 1939-5590.
- ^ Cutter, Gregory A.; Bruland, Kenneth W. (2012). «Rapid and noncontaminating sampling system for trace elements in global ocean surveys». Limnology and Oceanography: Methods. 10 (6): 425–436. doi:10.4319/lom.2012.10.425.
- ^ Bruland, K. W.; Lohan, M. C. (1 December 2003). «Controls of Trace Metals in Seawater». Treatise on Geochemistry. 6: 23–47. Bibcode:2003TrGeo…6…23B. doi:10.1016/B0-08-043751-6/06105-3. ISBN 978-0-08-043751-4.
- ^ Lass, Hans Ulrich; Mohrholz, Volker (November 2008). «On the interaction between the subtropical gyre and the Subtropical Cell on the shelf of the SE Atlantic». Journal of Marine Systems. 74 (1–2): 1–43. Bibcode:2008JMS….74….1L. doi:10.1016/j.jmarsys.2007.09.008.
- ^ International Seabed Authority. «Cobalt-Rich Crusts» (PDF). isa.org. International Seabed Authority. Retrieved 30 December 2020.
- ^ US Department of Commerce, National Oceanic and Atmospheric Administration. «DeepCCZ: Deep-sea Mining Interests in the Clarion-Clipperton Zone: NOAA Office of Ocean Exploration and Research». oceanexplorer.noaa.gov. National Oceanic and Atmospheric Administration. Retrieved 30 December 2020.
- ^ Hawco, Nicholas J.; McIlvin, Matthew M.; Bundy, Randelle M.; Tagliabue, Alessandro; Goepfert, Tyler J.; Moran, Dawn M.; Valentin-Alvarado, Luis; DiTullio, Giacomo R.; Saito, Mak A. (7 July 2020). «Minimal cobalt metabolism in the marine cyanobacterium Prochlorococcus». Proceedings of the National Academy of Sciences. 117 (27): 15740–15747. Bibcode:2020PNAS..11715740H. doi:10.1073/pnas.2001393117. PMC 7354930. PMID 32576688.
- ^ Lass, Hans Ulrich; Mohrholz, Volker (November 2008). «On the interaction between the subtropical gyre and the Subtropical Cell on the shelf of the SE Atlantic». Journal of Marine Systems. 74 (1–2): 1–43. Bibcode:2008JMS….74….1L. doi:10.1016/j.jmarsys.2007.09.008.
- ^ Karthikeyan, Panneerselvam; Marigoudar, Shambanagouda Rudragouda; Nagarjuna, Avula; Sharma, K. Venkatarama (2019). «Toxicity assessment of cobalt and selenium on marine diatoms and copepods». Environmental Chemistry and Ecotoxicology. 1: 36–42. doi:10.1016/j.enceco.2019.06.001.
- ^ Cobalt Statistics and Information (PDF), U.S. Geological Survey, 2018
- ^ a b c Shedd, Kim B. «Mineral Yearbook 2006: Cobalt» (PDF). United States Geological Survey. Retrieved 2008-10-26.
- ^ a b c Shedd, Kim B. «Commodity Report 2008: Cobalt» (PDF). United States Geological Survey. Retrieved 2008-10-26.
- ^ a b Henry Sanderson (March 14, 2017). «Cobalt’s meteoric rise at risk from Congo’s Katanga». Financial Times.
- ^ Murray W. Hitzman, Arthur A. Bookstrom, John F. Slack, and Michael L. Zientek (2017). «Cobalt—Styles of Deposits and the Search for Primary Deposits». USGS. Retrieved 17 April 2021.
- ^ «Cobalt price: BMW avoids the Congo conundrum – for now». Mining.com. Retrieved 17 April 2021.
- ^ Davis, Joseph R. (2000). ASM specialty handbook: nickel, cobalt, and their alloys. ASM International. p. 347. ISBN 0-87170-685-7.
- ^
«Cobalt» (PDF). United States Geological Survey, Mineral Commodity Summaries. January 2016. pp. 52–53. - ^ Thomas Wilson (October 26, 2017). «We’ll All Be Relying on Congo to Power Our Electric Cars».
- ^ «Glencore’s cobalt stock overhang contains prices despite mine suspension». Reuters. 8 August 2019.
- ^ «Glencore closes Mutanda mine, 20% of global cobalt supply comes offline». Benchmark Mineral Intelligence. 28 November 2019.
the mine would be placed on care and maintenance for a period of no less than two years
- ^
«African Mineral Production» (PDF). British Geological Survey. Retrieved 2009-06-06. - ^ a b
Frankel, Todd C. (2016-09-30). «Cobalt mining for lithium ion batteries has a high human cost». The Washington Post. Retrieved 2016-10-18. - ^ Mucha, Lena; Sadof, Karly Domb; Frankel, Todd C. (2018-02-28). «Perspective — The hidden costs of cobalt mining». The Washington Post. ISSN 0190-8286. Retrieved 2018-03-07.
- ^
Todd C. Frankel (September 30, 2016). «THE COBALT PIPELINE: Tracing the path from deadly hand-dug mines in Congo to consumers’ phones and laptops». The Washington Post. - ^ Crawford, Alex. Meet Dorsen, 8, who mines cobalt to make your smartphone work. Sky News UK. Retrieved on 2018-01-07.
- ^ Are you holding a product of child labour right now? (Video). Sky News UK (2017-02-28). Retrieved on 2018-01-07.
- ^
Child labour behind smart phone and electric car batteries. Amnesty International (2016-01-19). Retrieved on 2018-01-07. - ^
Reisinger, Don. (2017-03-03) Child Labor Revelation Prompts Apple to Make Supplier Policy Change. Fortune. Retrieved on 2018-01-07. - ^ Frankel, Todd C. (2017-03-03) Apple cracks down further on cobalt supplier in Congo as child labor persists. The Washington Post. Retrieved on 2018-01-07.
- ^
Wellmer, Friedrich-Wilhelm; Becker-Platen, Jens Dieter. «Global Nonfuel Mineral Resources and Sustainability». Retrieved 2009-05-16. - ^ Audit Report on Congo Dongfang International Mining sarl. DNV-GL Retrieved 18 April 2021.
- ^
«CAMEC – The Cobalt Champion» (PDF). International Mining. July 2008. Retrieved 2011-11-18. - ^
Amy Witherden (6 July 2009). «Daily podcast – July 6, 2009». Mining weekly. Retrieved 2011-11-15. - ^ Mining Journal «The [Ivanhoe] pullback investors have been waiting for», Aspermont Ltd., London, UK, February 22, 2018. Retrieved November 21, 2018.
- ^ Shabalala, Zandi «Cobalt to be declared a strategic mineral in Congo», Reuters, March 14, 2018. Retrieved October 3, 2018.]
- ^ Reuters «Congo’s Kabila signs into law new mining code», March 14, 2018. Retrieved October 3, 2018.]
- ^ [1] «DRC declares cobalt ‘strategic'», Mining Journal, December 4, 2018. Retrieved October 7, 2020.]
- ^ «U.S. cobalt lawsuit puts spotlight on ‘sustainable’ tech». Sustainability Times. 2019-12-17. Retrieved 2020-09-16.
- ^ «Apple, Google Fight Blame For Child Labor In Cobalt Mines — Law360». www.law360.com. Retrieved 2020-09-16.
- ^ The Canadian Ghost Town That Tesla Is Bringing Back to Life. Bloomberg (2017-10-31). Retrieved on 2018-01-07.
- ^ «Cubas Nickel Production Exceeds 50000 metric tons». Cuba Business Report. Retrieved 18 April 2021.
- ^
Donachie, Matthew J. (2002). Superalloys: A Technical Guide. ASM International. ISBN 978-0-87170-749-9. - ^ Campbell, Flake C (2008-06-30). «Cobalt and Cobalt Alloys». Elements of metallurgy and engineering alloys. pp. 557–558. ISBN 978-0-87170-867-0.
- ^ Michel, R.; Nolte, M.; Reich M.; Löer, F. (1991). «Systemic effects of implanted prostheses made of cobalt-chromium alloys». Archives of Orthopaedic and Trauma Surgery. 110 (2): 61–74. doi:10.1007/BF00393876. PMID 2015136. S2CID 28903564.
- ^ Disegi, John A. (1999). Cobalt-base Aloys for Biomedical Applications. ASTM International. p. 34. ISBN 0-8031-2608-5.
- ^ Luborsky, F. E.; Mendelsohn, L. I.; Paine, T. O. (1957). «Reproducing the Properties of Alnico Permanent Magnet Alloys with Elongated Single-Domain Cobalt-Iron Particles». Journal of Applied Physics. 28 (344): 344. Bibcode:1957JAP….28..344L. doi:10.1063/1.1722744.
- ^ Biggs, T.; Taylor, S. S.; Van Der Lingen, E. (2005). «The Hardening of Platinum Alloys for Potential Jewellery Application». Platinum Metals Review. 49: 2–15. doi:10.1595/147106705X24409.
- ^ a b c
Hawkins, M. (2001). «Why we need cobalt». Applied Earth Science. 110 (2): 66–71. Bibcode:2001AdEaS.110…66H. doi:10.1179/aes.2001.110.2.66. S2CID 137529349. - ^ a b
Armstrong, R. D.; Briggs, G. W. D.; Charles, E. A. (1988). «Some effects of the addition of cobalt to the nickel hydroxide electrode». Journal of Applied Electrochemistry. 18 (2): 215–219. doi:10.1007/BF01009266. S2CID 97073898. - ^
Zhang, P.; Yokoyama, Toshiro; Itabashi, Osamu; Wakui, Yoshito; Suzuki, Toshishige M.; Inoue, Katsutoshi (1999). «Recovery of metal values from spent nickel–metal hydride rechargeable batteries». Journal of Power Sources. 77 (2): 116–122. Bibcode:1999JPS….77..116Z. doi:10.1016/S0378-7753(98)00182-7. - ^ West, Karl (29 July 2017). «Carmakers’ electric dreams depend on supplies of rare minerals». The Guardian. eISSN 1756-3224. ISSN 0261-3077. OCLC 60623878. Archived from the original on 6 June 2022. Retrieved 29 June 2022.
- ^ Castellano, Robert (13 October 2017). «How To Minimize Tesla’s Cobalt Supply Chain Risk». Seeking Alpha. Archived from the original on 4 April 2022. Retrieved 29 June 2022.
- ^ a b «As Cobalt Supply Tightens, LiCo Energy Metals Announces Two New Cobalt Mines». cleantechnica.com. 2017-11-28. Retrieved 2018-01-07.
- ^ Shilling, Erik (31 October 2017). «We May Not Have Enough Minerals To Even Meet Electric Car Demand». Jalopnik. Archived from the original on 1 April 2022. Retrieved 29 June 2022.
- ^ «State of Charge: EVs, Batteries and Battery Materials (Free Report from @AdamasIntel)». Adamas Intelligence. 20 September 2019. Archived from the original on 20 October 2019. Retrieved 20 October 2019.
- ^ «Muskmobiles running rivals off the road». MINING.COM. 26 September 2019. Archived from the original on 2019-09-30.
- ^ «Electric car future may depend on deep sea mining». BBC News. 13 November 2019.
- ^
Hermes, Jennifer. (2017-05-31) Tesla & GE Face Major Shortage Of Ethically Sourced Cobalt. Environmentalleader.com. Retrieved on 2018-01-07. - ^ Electric cars yet to turn cobalt market into gold mine – Nornickel. MINING.com (2017-10-30). Retrieved on 2018-01-07.
- ^ «Why Have Cobalt Prices Crashed». International Banker. 31 July 2019. Archived from the original on 2019-11-30.
- ^ «Cobalt Prices and Cobalt Price Charts — InvestmentMine». www.infomine.com.
- ^ «Tesla joins «Fair Cobalt Alliance» to improve DRC artisanal mining». mining-technology.com. 2020-09-08. Retrieved 2020-09-26.
- ^ Klender, Joey (2020-09-08). «Tesla joins Fair Cobalt Alliance in support of moral mining efforts». teslarati.com. Retrieved 2020-09-26.
- ^ CObalt-free Batteries for FutuRe Automotive Applications website
- ^ COBRA project at European Union
- ^ Yoo-chul, Kim (2020-08-14). «Tesla’s battery strategy, implications for LG and Samsung». koreatimes.co.kr. Retrieved 2020-09-26.
- ^ Shahan, Zachary (2020-08-31). «Lithium & Nickel & Tesla, Oh My!». cleantechnica.com. Retrieved 2020-09-26.
- ^ Calma, Justine (2020-09-22). «Tesla to make EV battery cathodes without cobalt». theverge.com. Retrieved 2020-09-26.
- ^ «Cobalt Drier for Paints | Cobalt Cem-All®». Borchers. Retrieved 2021-05-15.
- ^ Weatherhead, R. G. (1980), Weatherhead, R. G. (ed.), «Catalysts, Accelerators and Inhibitors for Unsaturated Polyester Resins», FRP Technology: Fibre Reinforced Resin Systems, Dordrecht: Springer Netherlands, pp. 204–239, doi:10.1007/978-94-009-8721-0_10, ISBN 978-94-009-8721-0, retrieved 2021-05-15
- ^ «The product selector | AOC». aocresins.com. Retrieved 2021-05-15.
- ^ «Comar Chemicals — Polyester Acceleration». www.comarchemicals.com. Archived from the original on 2021-05-15. Retrieved 2021-05-15.
- ^
Khodakov, Andrei Y.; Chu, Wei & Fongarland, Pascal (2007). «Advances in the Development of Novel Cobalt Fischer-Tropsch Catalysts for Synthesis of Long-Chain Hydrocarbons and Clean Fuels». Chemical Reviews. 107 (5): 1692–1744. doi:10.1021/cr050972v. PMID 17488058. - ^
Hebrard, Frédéric & Kalck, Philippe (2009). «Cobalt-Catalyzed Hydroformylation of Alkenes: Generation and Recycling of the Carbonyl Species, and Catalytic Cycle». Chemical Reviews. 109 (9): 4272–4282. doi:10.1021/cr8002533. PMID 19572688. - ^
Overman, Frederick (1852). A treatise on metallurgy. D. Appleton & company. pp. 631–637. - ^
Muhlethaler, Bruno; Thissen, Jean; Muhlethaler, Bruno (1969). «Smalt». Studies in Conservation. 14 (2): 47–61. doi:10.2307/1505347. JSTOR 1505347. - ^
Gehlen, A. F. (1803). «Ueber die Bereitung einer blauen Farbe aus Kobalt, die eben so schön ist wie Ultramarin. Vom Bürger Thenard». Neues Allgemeines Journal der Chemie, Band 2. H. Frölich. (German translation from L. J. Thénard; Journal des Mines; Brumaire 12 1802; p 128–136) - ^
Witteveen, H. J.; Farnau, E. F. (1921). «Colors Developed by Cobalt Oxides». Industrial & Engineering Chemistry. 13 (11): 1061–1066. doi:10.1021/ie50143a048. - ^
Venetskii, S. (1970). «The charge of the guns of peace». Metallurgist. 14 (5): 334–336. doi:10.1007/BF00739447. S2CID 137225608. - ^
Mandeville, C.; Fulbright, H. (1943). «The Energies of the γ-Rays from Sb122, Cd115, Ir192, Mn54, Zn65, and Co60«. Physical Review. 64 (9–10): 265–267. Bibcode:1943PhRv…64..265M. doi:10.1103/PhysRev.64.265. - ^
Wilkinson, V. M; Gould, G (1998). Food irradiation: a reference guide. p. 53. ISBN 978-1-85573-359-6. - ^
Blakeslee, Sandra (1984-05-01). «The Juarez accident». The New York Times. Retrieved 2009-06-06. - ^
«Ciudad Juarez orphaned source dispersal, 1983». Wm. Robert Johnston. 2005-11-23. Retrieved 2009-10-24. - ^
National Research Council (U.S.). Committee on Radiation Source Use and Replacement; National Research Council (U.S.). Nuclear and Radiation Studies Board (January 2008). Radiation source use and replacement: abbreviated version. National Academies Press. pp. 35–. ISBN 978-0-309-11014-3. Retrieved 2011-04-29. - ^
Meyer, Theresa (2001-11-30). Physical Therapist Examination Review. p. 368. ISBN 978-1-55642-588-2. - ^
Kalnicky, D.; Singhvi, R. (2001). «Field portable XRF analysis of environmental samples». Journal of Hazardous Materials. 83 (1–2): 93–122. doi:10.1016/S0304-3894(00)00330-7. PMID 11267748. - ^
Payne, L. R. (1977). «The Hazards of Cobalt». Occupational Medicine. 27 (1): 20–25. doi:10.1093/occmed/27.1.20. PMID 834025. - ^
Puri-Mirza, Amna (2020). «Morocco Cobalt Production». Statistica. - ^ Davis, Joseph R; Handbook Committee, ASM International (2000-05-01). «Cobalt». Nickel, cobalt, and their alloys. p. 354. ISBN 978-0-87170-685-0.
- ^ Committee On Technological Alternatives For Cobalt Conservation, National Research Council (U.S.); National Materials Advisory Board, National Research Council (U.S.) (1983). «Ground–Coat Frit». Cobalt conservation through technological alternatives. p. 129.
- ^ Yamada, Kazuhiro (2013). «Chapter 9. Cobalt: Its Role in Health and Disease». In Astrid Sigel; Helmut Sigel; Roland K. O. Sigel (eds.). Interrelations between Essential Metal Ions and Human Diseases. Metal Ions in Life Sciences. Vol. 13. Springer. pp. 295–320. doi:10.1007/978-94-007-7500-8_9. PMID 24470095.
- ^
Cracan, Valentin; Banerjee, Ruma (2013). «Chapter 10 Cobalt and Corrinoid Transport and Biochemistry». In Banci, Lucia (ed.). Metallomics and the Cell. Metal Ions in Life Sciences. Vol. 12. Springer. pp. 333–374. doi:10.1007/978-94-007-5561-1_10. ISBN 978-94-007-5560-4. PMID 23595677. electronic-book ISBN 978-94-007-5561-1 ISSN 1559-0836 electronic-ISSN 1868-0402. - ^ Schwarz, F. J.; Kirchgessner, M.; Stangl, G. I. (2000). «Cobalt requirement of beef cattle – feed intake and growth at different levels of cobalt supply». Journal of Animal Physiology and Animal Nutrition. 83 (3): 121–131. doi:10.1046/j.1439-0396.2000.00258.x.
- ^ Voet, Judith G.; Voet, Donald (1995). Biochemistry. New York: J. Wiley & Sons. p. 675. ISBN 0-471-58651-X. OCLC 31819701.
- ^ Smith, David M.; Golding, Bernard T.; Radom, Leo (1999). «Understanding the Mechanism of B12-Dependent Methylmalonyl-CoA Mutase: Partial Proton Transfer in Action». Journal of the American Chemical Society. 121 (40): 9388–9399. doi:10.1021/ja991649a.
- ^ Kobayashi, Michihiko; Shimizu, Sakayu (1999). «Cobalt proteins». European Journal of Biochemistry. 261 (1): 1–9. doi:10.1046/j.1432-1327.1999.00186.x. PMID 10103026.
- ^ «Soils». Waikato University. Archived from the original on 2012-01-25. Retrieved 2012-01-16.
- ^ a b McDowell, Lee Russell (2008). Vitamins in Animal and Human Nutrition (2nd ed.). Hoboken: John Wiley & Sons. p. 525. ISBN 978-0-470-37668-3.
- ^ Australian Academy of Science > Deceased Fellows > Hedley Ralph Marston 1900–1965 Accessed 12 May 2013.
- ^ Snook, Laurence C. (1962). «Cobalt: its use to control wasting disease». Journal of the Department of Agriculture, Western Australia. 4. 3 (11): 844–852.
- ^ «Cobalt 356891». Sigma-Aldrich. 2021-10-14. Retrieved 2021-12-22.
- ^ Donaldson, John D. and Beyersmann, Detmar (2005) «Cobalt and Cobalt Compounds» in Ullmann’s Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim. doi:10.1002/14356007.a07_281.pub2
- ^ NIOSH Pocket Guide to Chemical Hazards. «#0146». National Institute for Occupational Safety and Health (NIOSH).
- ^ Morin Y; Tětu A; Mercier G (1969). «Quebec beer-drinkers’ cardiomyopathy: Clinical and hemodynamic aspects». Annals of the New York Academy of Sciences. 156 (1): 566–576. Bibcode:1969NYASA.156..566M. doi:10.1111/j.1749-6632.1969.tb16751.x. PMID 5291148. S2CID 7422045.
- ^ Barceloux, Donald G. & Barceloux, Donald (1999). «Cobalt». Clinical Toxicology. 37 (2): 201–216. doi:10.1081/CLT-100102420. PMID 10382556.
- ^ [PDF]
- ^ Elbagir, Nima; van Heerden, Dominique; Mackintosh, Eliza (May 2018). «Dirty Energy». CNN. Retrieved 30 May 2018.
- ^ Basketter, David A.; Angelini, Gianni; Ingber, Arieh; Kern, Petra S.; Menné, Torkil (2003). «Nickel, chromium and cobalt in consumer products: revisiting safe levels in the new millennium». Contact Dermatitis. 49 (1): 1–7. doi:10.1111/j.0105-1873.2003.00149.x. PMID 14641113. S2CID 24562378.
Further reading[edit]
- Harper, E. M.; Kavlak, G.; Graedel, T. E. (2012). «Tracking the metal of the goblins: Cobalt’s cycle of use». Environmental Science & Technology. 46 (2): 1079–86. Bibcode:2012EnST…46.1079H. doi:10.1021/es201874e. PMID 22142288. S2CID 206948482.
- Narendrula, R.; Nkongolo, K. K.; Beckett, P. (2012). «Comparative soil metal analyses in Sudbury (Ontario, Canada) and Lubumbashi (Katanga, DR-Congo)». Bulletin of Environmental Contamination and Toxicology. 88 (2): 187–92. doi:10.1007/s00128-011-0485-7. PMID 22139330. S2CID 34070357.
- Pauwels, H.; Pettenati, M.; Greffié, C. (2010). «The combined effect of abandoned mines and agriculture on groundwater chemistry». Journal of Contaminant Hydrology. 115 (1–4): 64–78. Bibcode:2010JCHyd.115…64P. doi:10.1016/j.jconhyd.2010.04.003. PMID 20466452.
- Bulut, G. (2006). «Recovery of copper and cobalt from ancient slag». Waste Management & Research. 24 (2): 118–24. doi:10.1177/0734242X06063350. PMID 16634226. S2CID 24931095.
- Jefferson, J. A.; Escudero, E.; Hurtado, M. E.; Pando, J.; Tapia, R.; Swenson, E. R.; Prchal, J.; Schreiner, G. F.; Schoene, R. B.; Hurtado, A.; Johnson, R. J. (2002). «Excessive erythrocytosis, chronic mountain sickness, and serum cobalt levels». Lancet. 359 (9304): 407–8. doi:10.1016/s0140-6736(02)07594-3. PMID 11844517. S2CID 12319751.
- Løvold, T. V.; Haugsbø, L. (1999). «Cobalt mining factory—diagnoses 1822-32». Tidsskrift for den Norske Laegeforening. 119 (30): 4544–6. PMID 10827501.
- Bird, G. A.; Hesslein, R. H.; Mills, K. H.; Schwartz, W. J.; Turner, M. A. (1998). «Bioaccumulation of radionuclides in fertilized Canadian Shield lake basins». The Science of the Total Environment. 218 (1): 67–83. Bibcode:1998ScTEn.218…67B. doi:10.1016/s0048-9697(98)00179-x. PMID 9718743.
- Nemery, B. (1990). «Metal toxicity and the respiratory tract». The European Respiratory Journal. 3 (2): 202–19. doi:10.1183/09031936.93.03020202. PMID 2178966.
- Kazantzis, G. (1981). «Role of cobalt, iron, lead, manganese, mercury, platinum, selenium, and titanium in carcinogenesis». Environmental Health Perspectives. 40: 143–61. doi:10.1289/ehp.8140143. PMC 1568837. PMID 7023929.
- Kerfoot, E. J.; Fredrick, W. G.; Domeier, E. (1975). «Cobalt metal inhalation studies on miniature swine». American Industrial Hygiene Association Journal. 36 (1): 17–25. doi:10.1080/0002889758507202. PMID 1111264.
External links[edit]
![]()
Wikimedia Commons has media related to Cobalt.
![]()
Look up cobalt in Wiktionary, the free dictionary.
- Cobalt at The Periodic Table of Videos (University of Nottingham)
- Centers for Disease and Prevention – Cobalt
- The Cobalt Institute
- Responsible Cobalt Institute Archived 2021-03-07 at the Wayback Machine
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cobalt | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Pronunciation | ( | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Appearance | hard lustrous bluish gray metal | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Standard atomic weight Ar°(Co) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cobalt in the periodic table | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic number (Z) | 27 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Group | group 9 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Period | period 4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Block | d-block | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electron configuration | [Ar] 3d7 4s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrons per shell | 2, 8, 15, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physical properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase at STP | solid | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Melting point | 1768 K (1495 °C, 2723 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Boiling point | 3200 K (2927 °C, 5301 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Density (near r.t.) | 8.90 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| when liquid (at m.p.) | 8.86 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of fusion | 16.06 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of vaporization | 377 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar heat capacity | 24.81 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Vapor pressure
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidation states | −3, −1, 0, +1, +2, +3, +4, +5[3] (an amphoteric oxide) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativity | Pauling scale: 1.88 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionization energies |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic radius | empirical: 125 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Covalent radius | Low spin: 126±3 pm High spin: 150±7 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Spectral lines of cobalt | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Other properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Natural occurrence | primordial | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | hexagonal close-packed (hcp)
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Speed of sound thin rod | 4720 m/s (at 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal expansion | 13.0 µm/(m⋅K) (at 25 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal conductivity | 100 W/(m⋅K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrical resistivity | 62.4 nΩ⋅m (at 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetic ordering | ferromagnetic | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Young’s modulus | 209 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Shear modulus | 75 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bulk modulus | 180 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poisson ratio | 0.31 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohs hardness | 5.0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vickers hardness | 1043 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brinell hardness | 470–3000 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS Number | 7440-48-4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| History | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Discovery and first isolation | Georg Brandt (1735) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Main isotopes of cobalt
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| references |
Cobalt is a chemical element with the symbol Co and atomic number 27. As with nickel, cobalt is found in the Earth’s crust only in a chemically combined form, save for small deposits found in alloys of natural meteoric iron. The free element, produced by reductive smelting, is a hard, lustrous, silver-gray metal.
Cobalt-based blue pigments (cobalt blue) have been used since ancient times for jewelry and paints, and to impart a distinctive blue tint to glass, but the color was for a long time thought to be due to the known metal bismuth. Miners had long used the name kobold ore (German for goblin ore) for some of the blue-pigment-producing minerals; they were so named because they were poor in known metals, and gave poisonous arsenic-containing fumes when smelted.[4] In 1735, such ores were found to be reducible to a new metal (the first discovered since ancient times), and this was ultimately named for the kobold.
Today, some cobalt is produced specifically from one of a number of metallic-lustered ores, such as cobaltite (CoAsS). The element is, however, more usually produced as a by-product of copper and nickel mining. The Copperbelt in the Democratic Republic of the Congo (DRC) and Zambia yields most of the global cobalt production. World production in 2016 was 116,000 tonnes (114,000 long tons; 128,000 short tons) (according to Natural Resources Canada), and the DRC alone accounted for more than 50%.[5]
Cobalt is primarily used in lithium-ion batteries, and in the manufacture of magnetic, wear-resistant and high-strength alloys. The compounds cobalt silicate and cobalt(II) aluminate (CoAl2O4, cobalt blue) give a distinctive deep blue color to glass, ceramics, inks, paints and varnishes. Cobalt occurs naturally as only one stable isotope, cobalt-59. Cobalt-60 is a commercially important radioisotope, used as a radioactive tracer and for the production of high-energy gamma rays.
Cobalt is the active center of a group of coenzymes called cobalamins. Vitamin B12, the best-known example of the type, is an essential vitamin for all animals. Cobalt in inorganic form is also a micronutrient for bacteria, algae, and fungi.
Characteristics[edit]

A block of electrolytically refined cobalt (99.9% purity) cut from a large plate
Cobalt is a ferromagnetic metal with a specific gravity of 8.9. The Curie temperature is 1,115 °C (2,039 °F)[6] and the magnetic moment is 1.6–1.7 Bohr magnetons per atom.[7] Cobalt has a relative permeability two-thirds that of iron.[8] Metallic cobalt occurs as two crystallographic structures: hcp and fcc. The ideal transition temperature between the hcp and fcc structures is 450 °C (842 °F), but in practice the energy difference between them is so small that random intergrowth of the two is common.[9][10][11]
Cobalt is a weakly reducing metal that is protected from oxidation by a passivating oxide film. It is attacked by halogens and sulfur. Heating in oxygen produces Co3O4 which loses oxygen at 900 °C (1,650 °F) to give the monoxide CoO.[12] The metal reacts with fluorine (F2) at 520 K to give CoF3; with chlorine (Cl2), bromine (Br2) and iodine (I2), producing equivalent binary halides. It does not react with hydrogen gas (H2) or nitrogen gas (N2) even when heated, but it does react with boron, carbon, phosphorus, arsenic and sulfur.[13] At ordinary temperatures, it reacts slowly with mineral acids, and very slowly with moist, but not with dry, air.[citation needed]
Compounds[edit]
Common oxidation states of cobalt include +2 and +3, although compounds with oxidation states ranging from −3 to +5 are also known. A common oxidation state for simple compounds is +2 (cobalt(II)). These salts form the pink-colored metal aquo complex [Co(H
2O)
6]2+
in water. Addition of chloride gives the intensely blue [CoCl
4]2−
.[3] In a borax bead flame test, cobalt shows deep blue in both oxidizing and reducing flames.[14]
Oxygen and chalcogen compounds[edit]
Several oxides of cobalt are known. Green cobalt(II) oxide (CoO) has rocksalt structure. It is readily oxidized with water and oxygen to brown cobalt(III) hydroxide (Co(OH)3). At temperatures of 600–700 °C, CoO oxidizes to the blue cobalt(II,III) oxide (Co3O4), which has a spinel structure.[3] Black cobalt(III) oxide (Co2O3) is also known.[15] Cobalt oxides are antiferromagnetic at low temperature: CoO (Néel temperature 291 K) and Co3O4 (Néel temperature: 40 K), which is analogous to magnetite (Fe3O4), with a mixture of +2 and +3 oxidation states.[16]
The principal chalcogenides of cobalt include the black cobalt(II) sulfides, CoS2, which adopts a pyrite-like structure, and cobalt(III) sulfide (Co2S3).[citation needed]
Halides[edit]

Cobalt(II) chloride hexahydrate
Four dihalides of cobalt(II) are known: cobalt(II) fluoride (CoF2, pink), cobalt(II) chloride (CoCl2, blue), cobalt(II) bromide (CoBr2, green), cobalt(II) iodide (CoI2, blue-black). These halides exist in anhydrous and hydrated forms. Whereas the anhydrous dichloride is blue, the hydrate is red.[17]
The reduction potential for the reaction Co3+
+ e− → Co2+
is +1.92 V, beyond that for chlorine to chloride, +1.36 V. Consequently, cobalt(III) chloride would spontaneously reduce to cobalt(II) chloride and chlorine. Because the reduction potential for fluorine to fluoride is so high, +2.87 V, cobalt(III) fluoride is one of the few simple stable cobalt(III) compounds. Cobalt(III) fluoride, which is used in some fluorination reactions, reacts vigorously with water.[12]
Coordination compounds[edit]
As for all metals, molecular compounds and polyatomic ions of cobalt are classified as coordination complexes, that is, molecules or ions that contain cobalt linked to one or more ligands. These can be combinations of a potentially infinite variety of molecules and ions, such as:
- water H
2O, as in the cation hexaaquocobalt(II) [Co(H
2O)
6]2+
. This pink-colored complex is the predominant cation in solid cobalt sulfate CoSO
4·(H
2O)x, with x = 6 or 7, as well as in water solutions thereof. - ammonia NH
3, as in cis-diaquotetraamminecobalt(III) [Co(NH
3)
4(H
2O)
2]3+
, in hexol [Co(Co(NH
3)
4(HO)
2)
3]6−
, in [Co(NO
2)
4(NH
3)
2]−
(the anion of Erdmann’s salt),[18] and in [Co(NH
3)
5(CO
3)]−
.[18] - carbonate [CO
3]2−
, as in the green triscarbonatocobaltate(III) [Co(CO
3)
3]3−
anion.[19][18][20] - nitrite [NO
2]−
as in [Co(NO
2)
4(NH
3)
2]−
.[18] - hydroxide [HO]−
, as in hexol. - chloride [Cl]−
, as in tetrachloridocobaltate(II) CoCl
4]2−
. - bicarbonate [HCO
3]−
, as in [Co(CO
3)
2(HCO
3)(H
2O)]3−
.[18] - oxalate [C
2O
4]2−
, as in trisoxalatocobaltate(III) [Co(C
2O
4)3−
3].[18]
These attached groups affect the stability of oxidation states of the cobalt atoms, according to general principles of electronegativity and of the hardness–softness. For example, Co3+ complexes tend to have ammine ligands. Because phosphorus is softer than nitrogen, phosphine ligands tend to feature the softer Co2+ and Co+, an example being tris(triphenylphosphine)cobalt(I) chloride (P(C
6H
5)
3)
3CoCl). The more electronegative (and harder) oxide and fluoride can stabilize Co4+ and Co5+ derivatives, e.g. caesium hexafluorocobaltate(IV) (Cs2CoF6) and potassium percobaltate (K3CoO4).[12]
Alfred Werner, a Nobel-prize winning pioneer in coordination chemistry, worked with compounds of empirical formula [Co(NH
3)
6]3+
. One of the isomers determined was cobalt(III) hexammine chloride. This coordination complex, a typical Werner-type complex, consists of a central cobalt atom coordinated by six ammine orthogonal ligands and three chloride counteranions. Using chelating ethylenediamine ligands in place of ammonia gives tris(ethylenediamine)cobalt(III) ([Co(en)
3]3+
), which was one of the first coordination complexes to be resolved into optical isomers. The complex exists in the right- and left-handed forms of a «three-bladed propeller». This complex was first isolated by Werner as yellow-gold needle-like crystals.[21][22]
Organometallic compounds[edit]

Structure of tetrakis(1-norbornyl)cobalt(IV)
Cobaltocene is a structural analog to ferrocene, with cobalt in place of iron. Cobaltocene is much more sensitive to oxidation than ferrocene.[23] Cobalt carbonyl (Co2(CO)8) is a catalyst in carbonylation and hydrosilylation reactions.[24] Vitamin B12 (see below) is an organometallic compound found in nature and is the only vitamin that contains a metal atom.[25] An example of an alkylcobalt complex in the otherwise uncommon +4 oxidation state of cobalt is the homoleptic complex tetrakis(1-norbornyl)cobalt(IV) (Co(1-norb)4), a transition metal-alkyl complex that is notable for its resistance to β-hydrogen elimination,[26] in accord with Bredt’s rule. The cobalt(III) and cobalt(V) complexes [Li(THF)
4]+
[Co(1-norb)
4]−
and [Co(1-norb)
4]+
[BF
4]−
are also known.[27]
Isotopes[edit]
59Co is the only stable cobalt isotope and the only isotope that exists naturally on Earth. Twenty-two radioisotopes have been characterized: the most stable, 60Co, has a half-life of 5.2714 years; 57Co has a half-life of 271.8 days; 56Co has a half-life of 77.27 days; and 58Co has a half-life of 70.86 days. All the other radioactive isotopes of cobalt have half-lives shorter than 18 hours, and in most cases shorter than 1 second. This element also has 4 meta states, all of which have half-lives shorter than 15 minutes.[28]
The isotopes of cobalt range in atomic weight from 50 u (50Co) to 73 u (73Co). The primary decay mode for isotopes with atomic mass unit values less than that of the only stable isotope, 59Co, is electron capture and the primary mode of decay in isotopes with atomic mass greater than 59 atomic mass units is beta decay. The primary decay products below 59Co are element 26 (iron) isotopes; above that the decay products are element 28 (nickel) isotopes.[28]
History[edit]

Early Chinese blue and white porcelain, manufactured c. 1335
Cobalt compounds have been used for centuries to impart a rich blue color to glass, glazes, and ceramics. Cobalt has been detected in Egyptian sculpture, Persian jewelry from the third millennium BC, in the ruins of Pompeii, destroyed in 79 AD, and in China, dating from the Tang dynasty (618–907 AD) and the Ming dynasty (1368–1644 AD).[29]
Cobalt has been used to color glass since the Bronze Age. The excavation of the Uluburun shipwreck yielded an ingot of blue glass, cast during the 14th century BC.[30][31] Blue glass from Egypt was either colored with copper, iron, or cobalt. The oldest cobalt-colored glass is from the eighteenth dynasty of Egypt (1550–1292 BC). The source for the cobalt the Egyptians used is not known.[32][33]
The word cobalt is derived from the German kobalt, from kobold meaning «goblin», a superstitious term used for the ore of cobalt by miners. The first attempts to smelt those ores for copper or silver failed, yielding simply powder (cobalt(II) oxide) instead. Because the primary ores of cobalt always contain arsenic, smelting the ore oxidized the arsenic into the highly toxic and volatile arsenic oxide, adding to the notoriety of the ore.[34]
Swedish chemist Georg Brandt (1694–1768) is credited with discovering cobalt circa 1735, showing it to be a previously unknown element, distinct from bismuth and other traditional metals. Brandt called it a new «semi-metal».[35][36] He showed that compounds of cobalt metal were the source of the blue color in glass, which previously had been attributed to the bismuth found with cobalt. Cobalt became the first metal to be discovered since the pre-historical period. All other known metals (iron, copper, silver, gold, zinc, mercury, tin, lead and bismuth) had no recorded discoverers.[37]
During the 19th century, a significant part of the world’s production of cobalt blue (a pigment made with cobalt compounds and alumina) and smalt (cobalt glass powdered for use for pigment purposes in ceramics and painting) was carried out at the Norwegian Blaafarveværket.[38][39] The first mines for the production of smalt in the 16th century were located in Norway, Sweden, Saxony and Hungary. With the discovery of cobalt ore in New Caledonia in 1864, the mining of cobalt in Europe declined. With the discovery of ore deposits in Ontario, Canada in 1904 and the discovery of even larger deposits in the Katanga Province in the Congo in 1914, the mining operations shifted again.[34] When the Shaba conflict started in 1978, the copper mines of Katanga Province nearly stopped production.[40][41] The impact on the world cobalt economy from this conflict was smaller than expected: cobalt is a rare metal, the pigment is highly toxic, and the industry had already established effective ways for recycling cobalt materials. In some cases, industry was able to change to cobalt-free alternatives.[40][41]
In 1938, John Livingood and Glenn T. Seaborg discovered the radioisotope cobalt-60.[42] This isotope was famously used at Columbia University in the 1950s to establish parity violation in radioactive beta decay.[43][44]
After World War II, the US wanted to guarantee the supply of cobalt ore for military uses (as the Germans had been doing) and prospected for cobalt within the U.S. border. An adequate supply of the ore was found in Idaho near Blackbird canyon in the side of a mountain. The firm Calera Mining Company started production at the site.[45]
It has been argued that cobalt will be one of the main objects of geopolitical competition in a world running on renewable energy and dependent on batteries, but this perspective has also been criticised for underestimating the power of economic incentives for expanded production.[46]
Occurrence[edit]
The stable form of cobalt is produced in supernovae through the r-process.[47] It comprises 0.0029% of the Earth’s crust. Free cobalt (the native metal) is not found on Earth because of the oxygen in the atmosphere and the chlorine in the ocean. Both are abundant enough in the upper layers of the Earth’s crust to prevent native metal cobalt from forming. Except as recently delivered in meteoric iron, pure cobalt in native metal form is unknown on Earth. The element has a medium abundance but natural compounds of cobalt are numerous and small amounts of cobalt compounds are found in most rocks, soils, plants, and animals.[citation needed]
In nature, cobalt is frequently associated with nickel. Both are characteristic components of meteoric iron, though cobalt is much less abundant in iron meteorites than nickel. As with nickel, cobalt in meteoric iron alloys may have been well enough protected from oxygen and moisture to remain as the free (but alloyed) metal,[48] though neither element is seen in that form in the ancient terrestrial crust.[citation needed]
Cobalt in compound form occurs in copper and nickel minerals. It is the major metallic component that combines with sulfur and arsenic in the sulfidic cobaltite (CoAsS), safflorite (CoAs2), glaucodot ((Co,Fe)AsS), and skutterudite (CoAs3) minerals.[12] The mineral cattierite is similar to pyrite and occurs together with vaesite in the copper deposits of Katanga Province.[49] When it reaches the atmosphere, weathering occurs; the sulfide minerals oxidize and form pink erythrite («cobalt glance»: Co3(AsO4)2·8H2O) and spherocobaltite (CoCO3).[50][51]
Cobalt is also a constituent of tobacco smoke.[52] The tobacco plant readily absorbs and accumulates heavy metals like cobalt from the surrounding soil in its leaves. These are subsequently inhaled during tobacco smoking.[53]
In the ocean[edit]
Cobalt is a trace metal involved in photosynthesis and nitrogen fixation detected in most ocean basins and is a limiting micronutrient for phytoplankton and cyanobacteria.[54][55] The Co-containing complex cobalamin is only synthesized by cyanobacteria and a few archaea, so dissolved cobalt concentrations are low in the upper ocean. Like Mn and Fe, Co has a hybrid profile of biological uptake by phytoplankton via photosynthesis in the upper ocean and scavenging in the deep ocean, although most scavenging is limited by complex organic ligands.[56][57] Co is recycled in the ocean by decaying organic matter that sinks below the upper ocean, although most is scavenged by oxidizing bacteria.[citation needed]
Sources of cobalt for many ocean bodies include rivers and terrestrial runoff with some input from hydrothermal vents.[58] In the deep ocean, cobalt sources are found lying on top of seamounts (which can be large or small) where ocean currents sweep the ocean floor to clear sediment over the span of millions of years allowing them to form as ferromanganese crusts.[59] Although limited mapping of the seafloor has been done, preliminary investigation indicates that there is a large amount of these cobalt-rich crusts located in the Clarion Clipperton Zone,[60] an area garnering increasing interest for deep sea mining ventures due to the mineral-rich environment within its domain. Anthropogenic input contributes as a non-natural source but in very low amounts. Dissolved cobalt (dCo) concentrations across oceans are controlled primarily by reservoirs where dissolved oxygen concentrations are low. The complex biochemical cycling of cobalt in the ocean is still not fully understood, but patterns of higher concentrations have been found in areas of low oxygen[61] such as the Oxygen Minimum Zone (OMZ) in the Southern Atlantic Ocean.[62]
Cobalt is considered toxic for marine environments at high concentrations.[63] Safe concentrations fall around 18 μg/L in marine waters for plankton such as diatoms.[citation needed]
Production[edit]

| Country | Production | Reserves |
|---|---|---|
| 64,000 | 3,500,000 | |
| 5,600 | 250,000 | |
| 5,000 | 1,200,000 | |
| 4,300 | 250,000 | |
| 4,200 | 500,000 | |
| 4,000 | 280,000 | |
| 3,800 | 150,000 | |
| 3,200 | 51,000 | |
| 2,900 | 270,000 | |
| 2,800 | — | |
| 2,500 | 29,000 | |
| 1,500 | ||
| 650 | 23,000 | |
| Other countries | 5,900 | 560,000 |
| World total | 110,000 | 7,100,000 |
The main ores of cobalt are cobaltite, erythrite, glaucodot and skutterudite (see above), but most cobalt is obtained by reducing the cobalt by-products of nickel and copper mining and smelting.[65][66]
Since cobalt is generally produced as a by-product, the supply of cobalt depends to a great extent on the economic feasibility of copper and nickel mining in a given market. Demand for cobalt was projected to grow 6% in 2017.[67]
Primary cobalt deposits are rare, such as those occurring in hydrothermal deposits, associated with ultramafic rocks, typified by the Bou-Azzer district of Morocco. At such locations, cobalt ores are mined exclusively, albeit at a lower concentration, and thus require more downstream processing for cobalt extraction.[68][69]
Several methods exist to separate cobalt from copper and nickel, depending on the concentration of cobalt and the exact composition of the used ore. One method is froth flotation, in which surfactants bind to ore components, leading to an enrichment of cobalt ores. Subsequent roasting converts the ores to cobalt sulfate, and the copper and the iron are oxidized to the oxide. Leaching with water extracts the sulfate together with the arsenates. The residues are further leached with sulfuric acid, yielding a solution of copper sulfate. Cobalt can also be leached from the slag of copper smelting.[70]
The products of the above-mentioned processes are transformed into the cobalt oxide (Co3O4). This oxide is reduced to metal by the aluminothermic reaction or reduction with carbon in a blast furnace.[12]

[edit]
The United States Geological Survey estimates world reserves of cobalt at 7,100,000 metric tons.[71] The Democratic Republic of the Congo (DRC) currently produces 63% of the world’s cobalt. This market share may reach 73% by 2025 if planned expansions by mining producers like Glencore Plc take place as expected. But by 2030, global demand could be 47 times more than it was in 2017, Bloomberg New Energy Finance has estimated.[72]
Changes that Congo made to mining laws in 2002 attracted new investments in Congolese copper and cobalt projects. Glencore’s Mutanda Mine shipped 24,500 tons of cobalt in 2016, 40% of Congo DRC’s output and nearly a quarter of global production. After oversupply, Glencore closed Mutanda for two years in late 2019.[73][74] Glencore’s Katanga Mining project is resuming as well and should produce 300,000 tons of copper and 20,000 tons of cobalt by 2019, according to Glencore.[67]

After hitting near-decade highs in early 2018 above US$100,000 per tonne, prices for cobalt used in the global electric battery supply chain slipped by 45% in the following 2 years. With the upsurge in Electric (EV) vehicle demand in 2020 and early 2021, cobalt prices rose to US$54,000 per tonne by March 2021.[citation needed]
Cobalt is ranked as a critical mineral by the United States, Japan, Republic of Korea, the United Kingdom and the European Union.[citation needed]
Democratic Republic of the Congo[edit]
In 2005, the top producer of cobalt was the copper deposits in the Democratic Republic of the Congo’s Katanga Province. Formerly Shaba province, the area had almost 40% of global reserves, reported the British Geological Survey in 2009.[75]
Artisanal mining supplied 17% to 40% of the DRC production.[76] Some 100,000 cobalt miners in Congo DRC use hand tools to dig hundreds of feet, with little planning and fewer safety measures, say workers and government and NGO officials, as well as The Washington Post reporters’ observations on visits to isolated mines. The lack of safety precautions frequently causes injuries or death.[77] Mining pollutes the vicinity and exposes local wildlife and indigenous communities to toxic metals thought to cause birth defects and breathing difficulties, according to health officials.[78]
Human rights activists have alleged, and investigative journalism reported confirmation,[79][80] that child labor is used in mining cobalt from African artisanal mines.[76][81] This revelation prompted cell phone maker Apple Inc., on March 3, 2017, to stop buying ore from suppliers such as Zhejiang Huayou Cobalt who source from artisanal mines in the DRC, and begin using only suppliers that are verified to meet its workplace standards.[82][83]
There is a push globally by the EU and major car manufacturers (OEM) for global production of cobalt to be sourced and produced sustainably, responsibly and traceability of the supply chain. Mining companies are adopting and practising ESG initiatives in line with OECD Guidance and putting in place evidence of zero to low carbon footprint activities in the supply chain production of Lithium-ion batteries. These initiatives are already taking place with major mining companies, Artisanal and Small-Scale Mining companies (ASM). Car manufacturers and battery manufacturer supply chains Tesla, VW, BMW, BASF, Glencore are participating in several initiatives, such as the Responsible Cobalt Initiative and Cobalt for Development study. In 2018 BMW Group in partnership with BASF, Samsung SDI and Samsung Electronics have launched a pilot project in the DRC over one pilot mine, to improve conditions and address challenges for artisanal miners and the surrounding communities.
The political and ethnic dynamics of the region have in the past caused outbreaks of violence and years of armed conflict and displaced populations. This instability affected the price of cobalt and also created perverse incentives for the combatants in the First and Second Congo Wars to prolong the fighting, since access to diamond mines and other valuable resources helped to finance their military goals—which frequently amounted to genocide—and also enriched the fighters themselves. While DR Congo has in the 2010s not recently been invaded by neighboring military forces, some of the richest mineral deposits adjoin areas where Tutsis and Hutus still frequently clash, unrest continues although on a smaller scale and refugees still flee outbreaks of violence.[84]
Cobalt extracted from small Congolese artisanal mining endeavors in 2007 supplied a single Chinese company, Congo DongFang International Mining. A subsidiary of Zhejiang Huayou Cobalt, one of the world’s largest cobalt producers, Congo DongFang supplied cobalt to some of the world’s largest battery manufacturers, who produced batteries for ubiquitous products like the Apple iPhones. Because of accused labour violations and environmental concerns, LG Chem subsequently audited Congo DongFang in accordance with OECD guidelines. LG Chem, which also produces battery materials for car companies, imposed a code of conduct on all suppliers that it inspects.[85]
The Mukondo Mountain project, operated by the Central African Mining and Exploration Company (CAMEC) in Katanga Province, may be the richest cobalt reserve in the world. It produced an estimated one-third of the total global cobalt production in 2008.[86] In July 2009, CAMEC announced a long-term agreement to deliver its entire annual production of cobalt concentrate from Mukondo Mountain to Zhejiang Galico Cobalt & Nickel Materials of China.[87]
In February 2018, global asset management firm AllianceBernstein defined the DRC as economically «the Saudi Arabia of the electric vehicle age», due to its cobalt resources, as essential to the lithium-ion batteries that drive electric vehicles.[88]
On March 9, 2018, President Joseph Kabila updated the 2002 mining code, increasing royalty charges and declaring cobalt and coltan «strategic metals».[89][90]
The 2002 mining code was effectively updated on December 4, 2018.[91]
In December 2019, International Rights Advocates, a human rights NGO, filed a landmark lawsuit against Apple, Tesla, Dell, Microsoft and Google company Alphabet for «knowingly benefiting from and aiding and abetting the cruel and brutal use of young children» in mining cobalt.[92] The companies in question denied their involvement in child labour.[93]
Canada[edit]
In 2017, some exploration companies were planning to survey old silver and cobalt mines in the area of Cobalt, Ontario where significant deposits are believed to lie.[94]
Cuba[edit]
Canada’s Sherritt International processes cobalt ores in nickel deposits from the Moa mines in Cuba, and the island has several others mines in Mayari, Camaguey, and Pinar del Rio. Continued investments by Sherritt International in Cuban nickel and cobalt production while acquiring mining rights for 17–20 years made the communist country third for cobalt reserves in 2019, before Canada itself.[95]
Applications[edit]
In 2016, 116,000 tonnes (128,000 short tons) of cobalt was used.[5]
Cobalt has been used in the production of high-performance alloys.[65][66] It is also used in some rechargeable batteries.
Alloys[edit]
Cobalt-based superalloys have historically consumed most of the cobalt produced.[65][66] The temperature stability of these alloys makes them suitable for turbine blades for gas turbines and aircraft jet engines, although nickel-based single-crystal alloys surpass them in performance.[96] Cobalt-based alloys are also corrosion- and wear-resistant, making them, like titanium, useful for making orthopedic implants that don’t wear down over time. The development of wear-resistant cobalt alloys started in the first decade of the 20th century with the stellite alloys, containing chromium with varying quantities of tungsten and carbon. Alloys with chromium and tungsten carbides are very hard and wear-resistant.[97] Special cobalt-chromium-molybdenum alloys like Vitallium are used for prosthetic parts (hip and knee replacements).[98] Cobalt alloys are also used for dental prosthetics as a useful substitute for nickel, which may be allergenic.[99] Some high-speed steels also contain cobalt for increased heat and wear resistance. The special alloys of aluminium, nickel, cobalt and iron, known as Alnico, and of samarium and cobalt (samarium-cobalt magnet) are used in permanent magnets.[100] It is also alloyed with 95% platinum for jewelry, yielding an alloy suitable for fine casting, which is also slightly magnetic.[101]
Batteries[edit]
Lithium cobalt oxide (LiCoO2) is widely used in lithium-ion battery cathodes. The material is composed of cobalt oxide layers with the lithium intercalated. During discharge (i.e. when not actively being charged), the lithium is released as lithium ions.[102] Nickel-cadmium[103] (NiCd) and nickel metal hydride[104] (NiMH) batteries also include cobalt to improve the oxidation of nickel in the battery.[103]
Transparency Market Research estimated the global lithium-ion battery market at $30 billion in 2015 and predicted an increase to over US$75 billion by 2024.[105]
Although in 2018 most cobalt in batteries was used in a mobile device,[106] a more recent application for cobalt is rechargeable batteries for electric cars. This industry has increased five-fold in its demand for cobalt, which makes it urgent to find new raw materials in more stable areas of the world.[107] Demand is expected to continue or increase as the prevalence of electric vehicles increases.[108] Exploration in 2016–2017 included the area around Cobalt, Ontario, an area where many silver mines ceased operation decades ago.[107] Cobalt for electric vehicles increased 81% from the first half of 2018 to 7,200 tonnes in the first half of 2019, for a battery capacity of 46.3 GWh.[109][110] The future of electric cars may depend on deep-sea mining, since cobalt is abundant in rocks on the seabed.[111]
Since child and slave labor have been repeatedly reported in cobalt mining, primarily in the artisanal mines of DR Congo, technology companies seeking an ethical supply chain have faced shortages of this raw material and[112] the price of cobalt metal reached a nine-year high in October 2017, more than US$30 a pound, versus US$10 in late 2015.[113] After oversupply, the price dropped to a more normal $15 in 2019.[114][115] As a reaction to the issues with artisanal cobalt mining in DR Congo a number of cobalt suppliers and their customers have formed the Fair Cobalt Alliance (FCA) which aims to end the use of child labor and to improve the working conditions of cobalt mining and processing in the DR Congo. Members of FCA include Zhejiang Huayou Cobalt, Sono Motors, the Responsible Cobalt Initiative, Fairphone, Glencore and Tesla, Inc.[116][117]
Research is being conducted by the European Union on the possibility to eliminate cobalt requirements in lithium-ion battery production.[118][119] As of August 2020 battery makers have gradually reduced the cathode cobalt content from 1/3 (NMC 111) to 2/10 (NMC 442) to currently 1/10 (NMC 811) and have also introduced the cobalt free LFP cathode into the battery packs of electric cars such as the Tesla Model 3.[120][121] In September 2020, Tesla outlined their plans to make their own, cobalt-free battery cells.[122]
Catalysts[edit]
Several cobalt compounds are oxidation catalysts. Cobalt acetate is used to convert xylene to terephthalic acid, the precursor of the bulk polymer polyethylene terephthalate. Typical catalysts are the cobalt carboxylates (known as cobalt soaps). They are also used in paints, varnishes, and inks as «drying agents» through the oxidation of drying oils.[123][102] The same carboxylates are used to improve the adhesion between steel and rubber in steel-belted radial tires. In addition they are used as accelerators in polyester resin systems.[124][125][126]
Cobalt-based catalysts are used in reactions involving carbon monoxide. Cobalt is also a catalyst in the Fischer–Tropsch process for the hydrogenation of carbon monoxide into liquid fuels.[127] Hydroformylation of alkenes often uses cobalt octacarbonyl as a catalyst,[128]
The hydrodesulfurization of petroleum uses a catalyst derived from cobalt and molybdenum. This process helps to clean petroleum of sulfur impurities that interfere with the refining of liquid fuels.[102]
Pigments and coloring[edit]


Before the 19th century, cobalt was predominantly used as a pigment. It has been used since the Middle Ages to make smalt, a blue-colored glass. Smalt is produced by melting a mixture of roasted mineral smaltite, quartz and potassium carbonate, which yields a dark blue silicate glass, which is finely ground after the production.[129] Smalt was widely used to color glass and as pigment for paintings.[130] In 1780, Sven Rinman discovered cobalt green, and in 1802 Louis Jacques Thénard discovered cobalt blue.[131] Cobalt pigments such as cobalt blue (cobalt aluminate), cerulean blue (cobalt(II) stannate), various hues of cobalt green (a mixture of cobalt(II) oxide and zinc oxide), and cobalt violet (cobalt phosphate) are used as artist’s pigments because of their superior chromatic stability.[132][133]
Radioisotopes[edit]
Cobalt-60 (Co-60 or 60Co) is useful as a gamma-ray source because it can be produced in predictable amounts with high activity by bombarding cobalt with neutrons. It produces gamma rays with energies of 1.17 and 1.33 MeV.[28][134]
Cobalt is used in external beam radiotherapy, sterilization of medical supplies and medical waste, radiation treatment of foods for sterilization (cold pasteurization),[135] industrial radiography (e.g. weld integrity radiographs), density measurements (e.g. concrete density measurements), and tank fill height switches. The metal has the unfortunate property of producing a fine dust, causing problems with radiation protection. Cobalt from radiotherapy machines has been a serious hazard when not discarded properly, and one of the worst radiation contamination accidents in North America occurred in 1984, when a discarded radiotherapy unit containing cobalt-60 was mistakenly disassembled in a junkyard in Juarez, Mexico.[136][137]
Cobalt-60 has a radioactive half-life of 5.27 years. Loss of potency requires periodic replacement of the source in radiotherapy and is one reason why cobalt machines have been largely replaced by linear accelerators in modern radiation therapy.[138] Cobalt-57 (Co-57 or 57Co) is a cobalt radioisotope most often used in medical tests, as a radiolabel for vitamin B12 uptake, and for the Schilling test. Cobalt-57 is used as a source in Mössbauer spectroscopy and is one of several possible sources in X-ray fluorescence devices.[139][140]
Nuclear weapon designs could intentionally incorporate 59Co, some of which would be activated in a nuclear explosion to produce 60Co. The 60Co, dispersed as nuclear fallout, is sometimes called a cobalt bomb.[141]
[142]
Other uses[edit]
- Cobalt is used in electroplating for its attractive appearance, hardness, and resistance to oxidation.[143]
- It is also used as a base primer coat for porcelain enamels.[144]
Biological role[edit]
Cobalt is essential to the metabolism of all animals. It is a key constituent of cobalamin, also known as vitamin B12, the primary biological reservoir of cobalt as an ultratrace element.[145][146] Bacteria in the stomachs of ruminant animals convert cobalt salts into vitamin B12, a compound which can only be produced by bacteria or archaea. A minimal presence of cobalt in soils therefore markedly improves the health of grazing animals, and an uptake of 0.20 mg/kg a day is recommended because they have no other source of vitamin B12.[147]
Proteins based on cobalamin use corrin to hold the cobalt. Coenzyme B12 features a reactive C-Co bond that participates in the reactions.[148] In humans, B12 has two types of alkyl ligand: methyl and adenosyl. MeB12 promotes methyl (−CH3) group transfers. The adenosyl version of B12 catalyzes rearrangements in which a hydrogen atom is directly transferred between two adjacent atoms with concomitant exchange of the second substituent, X, which may be a carbon atom with substituents, an oxygen atom of an alcohol, or an amine. Methylmalonyl coenzyme A mutase (MUT) converts MMl-CoA to Su-CoA, an important step in the extraction of energy from proteins and fats.[149]
Although far less common than other metalloproteins (e.g. those of zinc and iron), other cobaltoproteins are known besides B12. These proteins include methionine aminopeptidase 2, an enzyme that occurs in humans and other mammals that does not use the corrin ring of B12, but binds cobalt directly. Another non-corrin cobalt enzyme is nitrile hydratase, an enzyme in bacteria that metabolizes nitriles.[150]
Cobalt deficiency[edit]
In humans, consumption of cobalt-containing vitamin B12 meets all needs for cobalt. For cattle and sheep, which meet vitamin B12 needs via synthesis by resident bacteria in the rumen, there is a function for inorganic cobalt. In the early 20th century, during the development of farming on the North Island Volcanic Plateau of New Zealand, cattle suffered from what was termed «bush sickness». It was discovered that the volcanic soils lacked the cobalt salts essential for the cattle food chain.[151][152] The «coast disease» of sheep in the Ninety Mile Desert of the Southeast of South Australia in the 1930s was found to originate in nutritional deficiencies of trace elements cobalt and copper. The cobalt deficiency was overcome by the development of «cobalt bullets», dense pellets of cobalt oxide mixed with clay given orally for lodging in the animal’s rumen.[clarification needed][153][152][154]
-

-

Cobalt-deficient sheep
Health issues[edit]
| Hazards | |
|---|---|
| GHS labelling:[155] | |
| Pictograms |   |
| Signal word | Danger |
| Hazard statements | H302, H317, H319, H334, H341, H350, H360F, H412 |
| Precautionary statements | P273, P280, P301+P312, P302+P352, P305+P351+P338, P308+P313 |
| NFPA 704 (fire diamond) |
2 0 0 |
The LD50 value for soluble cobalt salts has been estimated to be between 150 and 500 mg/kg.[156] In the US, the Occupational Safety and Health Administration (OSHA) has designated a permissible exposure limit (PEL) in the workplace as a time-weighted average (TWA) of 0.1 mg/m3. The National Institute for Occupational Safety and Health (NIOSH) has set a recommended exposure limit (REL) of 0.05 mg/m3, time-weighted average. The IDLH (immediately dangerous to life and health) value is 20 mg/m3.[157]
However, chronic cobalt ingestion has caused serious health problems at doses far less than the lethal dose. In 1966, the addition of cobalt compounds to stabilize beer foam in Canada led to a peculiar form of toxin-induced cardiomyopathy, which came to be known as beer drinker’s cardiomyopathy.[158][159]
Furthermore, cobalt metal is suspected of causing cancer (i.e., possibly carcinogenic, IARC Group 2B) as per the International Agency for Research on Cancer (IARC) Monographs.[160]
It causes respiratory problems when inhaled.[161] It also causes skin problems when touched; after nickel and chromium, cobalt is a major cause of contact dermatitis.[162]
References[edit]
- ^ «cobalt». Oxford English Dictionary (2nd ed.). Oxford University Press. 1989.
- ^ «Standard Atomic Weights: Cobalt». CIAAW. 2017.
- ^ a b c Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. pp. 1117–1119. ISBN 978-0-08-037941-8.
- ^ «cobalt». Oxford English Dictionary (2nd ed.). Oxford University Press. 1989.
- ^ a b Danielle Bochove (November 1, 2017). «Electric car future spurs Cobalt rush: Swelling demand for product breathes new life into small Ontario town». Vancouver Sun. Bloomberg. Archived from the original on 2019-07-28.
- ^ Enghag, Per (2004). «Cobalt». Encyclopedia of the elements: technical data, history, processing, applications. p. 667. ISBN 978-3-527-30666-4.
- ^ Murthy, V. S. R (2003). «Magnetic Properties of Materials». Structure And Properties Of Engineering Materials. p. 381. ISBN 978-0-07-048287-6.
- ^ Celozzi, Salvatore; Araneo, Rodolfo; Lovat, Giampiero (2008-05-01). Electromagnetic Shielding. p. 27. ISBN 978-0-470-05536-6.
- ^ Lee, B.; Alsenz, R.; Ignatiev, A.; Van Hove, M.; Van Hove, M. A. (1978). «Surface structures of the two allotropic phases of cobalt». Physical Review B. 17 (4): 1510–1520. Bibcode:1978PhRvB..17.1510L. doi:10.1103/PhysRevB.17.1510.
- ^ «Properties and Facts for Cobalt». American Elements. Archived from the original on 2008-10-02. Retrieved 2008-09-19.
- ^ Cobalt, Centre d’Information du Cobalt, Brussels (1966). Cobalt. p. 45.
{{cite book}}: CS1 maint: multiple names: authors list (link) - ^ a b c d e Holleman, A. F.; Wiberg, E.; Wiberg, N. (2007). «Cobalt». Lehrbuch der Anorganischen Chemie (in German) (102nd ed.). de Gruyter. pp. 1146–1152. ISBN 978-3-11-017770-1.
- ^ Housecroft, C. E.; Sharpe, A. G. (2008). Inorganic Chemistry (3rd ed.). Prentice Hall. p. 722. ISBN 978-0-13-175553-6.
- ^ Rutley, Frank (2012-12-06). Rutley’s Elements of Mineralogy. Springer Science & Business Media. p. 40. ISBN 978-94-011-9769-4.
- ^ Krebs, Robert E. (2006). The history and use of our earth’s chemical elements: a reference guide (2nd ed.). Greenwood Publishing Group. p. 107. ISBN 0-313-33438-2.
- ^ Petitto, Sarah C.; Marsh, Erin M.; Carson, Gregory A.; Langell, Marjorie A. (2008). «Cobalt oxide surface chemistry: The interaction of CoO(100), Co3O4(110) and Co3O4(111) with oxygen and water». Journal of Molecular Catalysis A: Chemical. 281 (1–2): 49–58. doi:10.1016/j.molcata.2007.08.023. S2CID 28393408.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. pp. 1119–1120. ISBN 978-0-08-037941-8.
- ^ a b c d e f Thomas P. McCutcheon and William J. Schuele (1953): «Complex Acids of Cobalt and Chromium. The Green Carbonatocobalt(III) Anion». Journal of the American Chemical Society, volume 75, issue 8, pages 1845–1846. doi:10.1021/ja01104a019
- ^ H. F. Bauer and W. C. Drinkard (1960): «A General Synthesis of Cobalt(III) Complexes; A New Intermediate, Na3[Co(CO3)3]·3H2O». Journal of the American Chemical Society, volume 82, issue 19, pages 5031–5032. doi:10.1021/ja01504a004.
- ^ Fikru Tafesse, Elias Aphane, and Elizabeth Mongadi (2009): «Determination of the structural formula of sodium tris-carbonatocobaltate(III), Na3[Co(CO3)3]·3H2O by thermogravimetry». Journal of Thermal Analysis and Calorimetry, volume 102, issue 1, pages 91–97. doi:10.1007/s10973-009-0606-2
- ^ Werner, A. (1912). «Zur Kenntnis des asymmetrischen Kobaltatoms. V». Chemische Berichte. 45: 121–130. doi:10.1002/cber.19120450116.
- ^ Gispert, Joan Ribas (2008). «Early Theories of Coordination Chemistry». Coordination chemistry. pp. 31–33. ISBN 978-3-527-31802-5. Archived from the original on 2016-05-05. Retrieved 2015-06-27.
- ^
James E. House (2008). Inorganic chemistry. Academic Press. pp. 767–. ISBN 978-0-12-356786-4. Retrieved 2011-05-16. - ^ Charles M. Starks; Charles Leonard Liotta; Marc Halpern (1994). Phase-transfer catalysis: fundamentals, applications, and industrial perspectives. Springer. pp. 600–. ISBN 978-0-412-04071-9. Retrieved 2011-05-16.
- ^ Sigel, Astrid; Sigel, Helmut; Sigel, Roland, eds. (2010). Organometallics in Environment and Toxicology (Metal Ions in Life Sciences). Cambridge, UK: Royal Society of Chemistry Publishing. p. 75. ISBN 978-1-84755-177-1.
- ^
Byrne, Erin K.; Richeson, Darrin S.; Theopold, Klaus H. (1986-01-01). «Tetrakis(1-norbornyl)cobalt, a low spin tetrahedral complex of a first row transition metal». Journal of the Chemical Society, Chemical Communications (19): 1491. doi:10.1039/C39860001491. ISSN 0022-4936. - ^
Byrne, Erin K.; Theopold, Klaus H. (1987-02-01). «Redox chemistry of tetrakis(1-norbornyl)cobalt. Synthesis and characterization of a cobalt(V) alkyl and self-exchange rate of a Co(III)/Co(IV) couple». Journal of the American Chemical Society. 109 (4): 1282–1283. doi:10.1021/ja00238a066. ISSN 0002-7863. - ^ a b c Audi, Georges; Bersillon, Olivier; Blachot, Jean; Wapstra, Aaldert Hendrik (2003), «The NUBASE evaluation of nuclear and decay properties», Nuclear Physics A, 729: 3–128, Bibcode:2003NuPhA.729….3A, doi:10.1016/j.nuclphysa.2003.11.001
- ^ Cobalt, Encyclopædia Britannica Online.
- ^
Pulak, Cemal (1998). «The Uluburun shipwreck: an overview». International Journal of Nautical Archaeology. 27 (3): 188–224. doi:10.1111/j.1095-9270.1998.tb00803.x. - ^
Henderson, Julian (2000). «Glass». The Science and Archaeology of Materials: An Investigation of Inorganic Materials. Routledge. p. 60. ISBN 978-0-415-19933-9. - ^
Rehren, Th. (2003). «Aspects of the Production of Cobalt-blue Glass in Egypt». Archaeometry. 43 (4): 483–489. doi:10.1111/1475-4754.00031. - ^ Lucas, A. (2003). Ancient Egyptian Materials and Industries. Kessinger Publishing. p. 217. ISBN 978-0-7661-5141-3.
- ^ a b Dennis, W. H (2010). «Cobalt». Metallurgy: 1863–1963. pp. 254–256. ISBN 978-0-202-36361-5.
- ^ Georg Brandt first showed cobalt to be a new metal in: G. Brandt (1735) «Dissertatio de semimetallis» (Dissertation on semi-metals), Acta Literaria et Scientiarum Sveciae (Journal of Swedish literature and sciences), vol. 4, pages 1–10.
See also: (1) G. Brandt (1746) «Rön och anmärkningar angäende en synnerlig färg—cobolt» (Observations and remarks concerning an extraordinary pigment—cobalt), Kongliga Svenska vetenskapsakademiens handlingar (Transactions of the Royal Swedish Academy of Science), vol. 7, pp. 119–130; (2) G. Brandt (1748) «Cobalti nova species examinata et descripta» (Cobalt, a new element examined and described), Acta Regiae Societatis Scientiarum Upsaliensis (Journal of the Royal Scientific Society of Uppsala), 1st series, vol. 3, pp. 33–41; (3) James L. Marshall and Virginia R. Marshall (Spring 2003) «Rediscovery of the Elements: Riddarhyttan, Sweden». The Hexagon (official journal of the Alpha Chi Sigma fraternity of chemists), vol. 94, no. 1, pages 3–8. - ^
Wang, Shijie (2006). «Cobalt—Its recovery, recycling, and application». Journal of the Minerals, Metals and Materials Society. 58 (10): 47–50. Bibcode:2006JOM….58j..47W. doi:10.1007/s11837-006-0201-y. S2CID 137613322. - ^ Weeks, Mary Elvira (1932). «The discovery of the elements. III. Some eighteenth-century metals». Journal of Chemical Education. 9 (1): 22. Bibcode:1932JChEd…9…22W. doi:10.1021/ed009p22.
- ^ Ramberg, Ivar B. (2008). The making of a land: geology of Norway. Geological Society. pp. 98–. ISBN 978-82-92394-42-7. Retrieved 2011-04-30.
- ^ Cyclopaedia (1852). C. Tomlinson. 9 divs (ed.). Cyclopædia of useful arts & manufactures. pp. 400–. Retrieved 2011-04-30.
- ^ a b Wellmer, Friedrich-Wilhelm; Becker-Platen, Jens Dieter. «Global Nonfuel Mineral Resources and Sustainability». United States Geological Survey.
- ^ a b Westing, Arthur H; Stockholm International Peace Research Institute (1986). «cobalt». Global resources and international conflict: environmental factors in strategic policy and action. pp. 75–78. ISBN 978-0-19-829104-6.
- ^ Livingood, J.; Seaborg, Glenn T. (1938). «Long-Lived Radio Cobalt Isotopes». Physical Review. 53 (10): 847–848. Bibcode:1938PhRv…53..847L. doi:10.1103/PhysRev.53.847.
- ^ Wu, C. S. (1957). «Experimental Test of Parity Conservation in Beta Decay». Physical Review. 105 (4): 1413–1415. Bibcode:1957PhRv..105.1413W. doi:10.1103/PhysRev.105.1413.
- ^ Wróblewski, A. K. (2008). «The Downfall of Parity – the Revolution That Happened Fifty Years Ago». Acta Physica Polonica B. 39 (2): 251. Bibcode:2008AcPPB..39..251W. S2CID 34854662.
- ^ «Richest Hole In The Mountain». Popular Mechanics: 65–69. 1952.
- ^ Overland, Indra (2019-03-01). «The geopolitics of renewable energy: Debunking four emerging myths». Energy Research & Social Science. 49: 36–40. doi:10.1016/j.erss.2018.10.018. ISSN 2214-6296.
- ^ Ptitsyn, D. A.; Chechetkin, V. M. (1980). «Creation of the Iron-Group Elements in a Supernova Explosion». Soviet Astronomy Letters. 6: 61–64. Bibcode:1980SvAL….6…61P.
- ^ Nuccio, Pasquale Mario and Valenza, Mariano (1979). «Determination of metallic iron, nickel and cobalt in meteorites» (PDF). Rendiconti Societa Italiana di Mineralogia e Petrografia. 35 (1): 355–360.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^
Kerr, Paul F. (1945). «Cattierite and Vaesite: New Co-Ni Minerals from the Belgian Kongo» (PDF). American Mineralogist. 30: 483–492. - ^ Buckley, A. N. (1987). «The Surface Oxidation of Cobaltite». Australian Journal of Chemistry. 40 (2): 231. doi:10.1071/CH9870231.
- ^ Young, R. (1957). «The geochemistry of cobalt». Geochimica et Cosmochimica Acta. 13 (1): 28–41. Bibcode:1957GeCoA..13…28Y. doi:10.1016/0016-7037(57)90056-X.
- ^
Talhout, Reinskje; Schulz, Thomas; Florek, Ewa; Van Benthem, Jan; Wester, Piet; Opperhuizen, Antoon (2011). «Hazardous Compounds in Tobacco Smok». International Journal of Environmental Research and Public Health. 8 (12): 613–628. doi:10.3390/ijerph8020613. ISSN 1660-4601. PMC 3084482. PMID 21556207. - ^
Pourkhabbaz, A; Pourkhabbaz, H (2012). «Investigation of Toxic Metals in the Tobacco of Different Iranian Cigarette Brands and Related Health Issues». Iranian Journal of Basic Medical Sciences. 15 (1): 636–644. PMC 3586865. PMID 23493960. - ^ Bundy, Randelle M.; Tagliabue, Alessandro; Hawco, Nicholas J.; Morton, Peter L.; Twining, Benjamin S.; Hatta, Mariko; Noble, Abigail E.; Cape, Mattias R.; John, Seth G.; Cullen, Jay T.; Saito, Mak A. (1 October 2020). «Elevated sources of cobalt in the Arctic Ocean». Biogeosciences. 17 (19): 4745–4767. Bibcode:2020BGeo…17.4745B. doi:10.5194/bg-17-4745-2020. Retrieved 24 November 2020.
- ^ Noble, Abigail E.; Lamborg, Carl H.; Ohnemus, Dan C.; Lam, Phoebe J.; Goepfert, Tyler J.; Measures, Chris I.; Frame, Caitlin H.; Casciotti, Karen L.; DiTullio, Giacomo R.; Jennings, Joe; Saito, Mak A. (2012). «Basin-scale inputs of cobalt, iron, and manganese from the Benguela-Angola front to the South Atlantic Ocean». Limnology and Oceanography. 57 (4): 989–1010. Bibcode:2012LimOc..57..989N. doi:10.4319/lo.2012.57.4.0989. ISSN 1939-5590.
- ^ Cutter, Gregory A.; Bruland, Kenneth W. (2012). «Rapid and noncontaminating sampling system for trace elements in global ocean surveys». Limnology and Oceanography: Methods. 10 (6): 425–436. doi:10.4319/lom.2012.10.425.
- ^ Bruland, K. W.; Lohan, M. C. (1 December 2003). «Controls of Trace Metals in Seawater». Treatise on Geochemistry. 6: 23–47. Bibcode:2003TrGeo…6…23B. doi:10.1016/B0-08-043751-6/06105-3. ISBN 978-0-08-043751-4.
- ^ Lass, Hans Ulrich; Mohrholz, Volker (November 2008). «On the interaction between the subtropical gyre and the Subtropical Cell on the shelf of the SE Atlantic». Journal of Marine Systems. 74 (1–2): 1–43. Bibcode:2008JMS….74….1L. doi:10.1016/j.jmarsys.2007.09.008.
- ^ International Seabed Authority. «Cobalt-Rich Crusts» (PDF). isa.org. International Seabed Authority. Retrieved 30 December 2020.
- ^ US Department of Commerce, National Oceanic and Atmospheric Administration. «DeepCCZ: Deep-sea Mining Interests in the Clarion-Clipperton Zone: NOAA Office of Ocean Exploration and Research». oceanexplorer.noaa.gov. National Oceanic and Atmospheric Administration. Retrieved 30 December 2020.
- ^ Hawco, Nicholas J.; McIlvin, Matthew M.; Bundy, Randelle M.; Tagliabue, Alessandro; Goepfert, Tyler J.; Moran, Dawn M.; Valentin-Alvarado, Luis; DiTullio, Giacomo R.; Saito, Mak A. (7 July 2020). «Minimal cobalt metabolism in the marine cyanobacterium Prochlorococcus». Proceedings of the National Academy of Sciences. 117 (27): 15740–15747. Bibcode:2020PNAS..11715740H. doi:10.1073/pnas.2001393117. PMC 7354930. PMID 32576688.
- ^ Lass, Hans Ulrich; Mohrholz, Volker (November 2008). «On the interaction between the subtropical gyre and the Subtropical Cell on the shelf of the SE Atlantic». Journal of Marine Systems. 74 (1–2): 1–43. Bibcode:2008JMS….74….1L. doi:10.1016/j.jmarsys.2007.09.008.
- ^ Karthikeyan, Panneerselvam; Marigoudar, Shambanagouda Rudragouda; Nagarjuna, Avula; Sharma, K. Venkatarama (2019). «Toxicity assessment of cobalt and selenium on marine diatoms and copepods». Environmental Chemistry and Ecotoxicology. 1: 36–42. doi:10.1016/j.enceco.2019.06.001.
- ^ Cobalt Statistics and Information (PDF), U.S. Geological Survey, 2018
- ^ a b c Shedd, Kim B. «Mineral Yearbook 2006: Cobalt» (PDF). United States Geological Survey. Retrieved 2008-10-26.
- ^ a b c Shedd, Kim B. «Commodity Report 2008: Cobalt» (PDF). United States Geological Survey. Retrieved 2008-10-26.
- ^ a b Henry Sanderson (March 14, 2017). «Cobalt’s meteoric rise at risk from Congo’s Katanga». Financial Times.
- ^ Murray W. Hitzman, Arthur A. Bookstrom, John F. Slack, and Michael L. Zientek (2017). «Cobalt—Styles of Deposits and the Search for Primary Deposits». USGS. Retrieved 17 April 2021.
- ^ «Cobalt price: BMW avoids the Congo conundrum – for now». Mining.com. Retrieved 17 April 2021.
- ^ Davis, Joseph R. (2000). ASM specialty handbook: nickel, cobalt, and their alloys. ASM International. p. 347. ISBN 0-87170-685-7.
- ^
«Cobalt» (PDF). United States Geological Survey, Mineral Commodity Summaries. January 2016. pp. 52–53. - ^ Thomas Wilson (October 26, 2017). «We’ll All Be Relying on Congo to Power Our Electric Cars».
- ^ «Glencore’s cobalt stock overhang contains prices despite mine suspension». Reuters. 8 August 2019.
- ^ «Glencore closes Mutanda mine, 20% of global cobalt supply comes offline». Benchmark Mineral Intelligence. 28 November 2019.
the mine would be placed on care and maintenance for a period of no less than two years
- ^
«African Mineral Production» (PDF). British Geological Survey. Retrieved 2009-06-06. - ^ a b
Frankel, Todd C. (2016-09-30). «Cobalt mining for lithium ion batteries has a high human cost». The Washington Post. Retrieved 2016-10-18. - ^ Mucha, Lena; Sadof, Karly Domb; Frankel, Todd C. (2018-02-28). «Perspective — The hidden costs of cobalt mining». The Washington Post. ISSN 0190-8286. Retrieved 2018-03-07.
- ^
Todd C. Frankel (September 30, 2016). «THE COBALT PIPELINE: Tracing the path from deadly hand-dug mines in Congo to consumers’ phones and laptops». The Washington Post. - ^ Crawford, Alex. Meet Dorsen, 8, who mines cobalt to make your smartphone work. Sky News UK. Retrieved on 2018-01-07.
- ^ Are you holding a product of child labour right now? (Video). Sky News UK (2017-02-28). Retrieved on 2018-01-07.
- ^
Child labour behind smart phone and electric car batteries. Amnesty International (2016-01-19). Retrieved on 2018-01-07. - ^
Reisinger, Don. (2017-03-03) Child Labor Revelation Prompts Apple to Make Supplier Policy Change. Fortune. Retrieved on 2018-01-07. - ^ Frankel, Todd C. (2017-03-03) Apple cracks down further on cobalt supplier in Congo as child labor persists. The Washington Post. Retrieved on 2018-01-07.
- ^
Wellmer, Friedrich-Wilhelm; Becker-Platen, Jens Dieter. «Global Nonfuel Mineral Resources and Sustainability». Retrieved 2009-05-16. - ^ Audit Report on Congo Dongfang International Mining sarl. DNV-GL Retrieved 18 April 2021.
- ^
«CAMEC – The Cobalt Champion» (PDF). International Mining. July 2008. Retrieved 2011-11-18. - ^
Amy Witherden (6 July 2009). «Daily podcast – July 6, 2009». Mining weekly. Retrieved 2011-11-15. - ^ Mining Journal «The [Ivanhoe] pullback investors have been waiting for», Aspermont Ltd., London, UK, February 22, 2018. Retrieved November 21, 2018.
- ^ Shabalala, Zandi «Cobalt to be declared a strategic mineral in Congo», Reuters, March 14, 2018. Retrieved October 3, 2018.]
- ^ Reuters «Congo’s Kabila signs into law new mining code», March 14, 2018. Retrieved October 3, 2018.]
- ^ [1] «DRC declares cobalt ‘strategic'», Mining Journal, December 4, 2018. Retrieved October 7, 2020.]
- ^ «U.S. cobalt lawsuit puts spotlight on ‘sustainable’ tech». Sustainability Times. 2019-12-17. Retrieved 2020-09-16.
- ^ «Apple, Google Fight Blame For Child Labor In Cobalt Mines — Law360». www.law360.com. Retrieved 2020-09-16.
- ^ The Canadian Ghost Town That Tesla Is Bringing Back to Life. Bloomberg (2017-10-31). Retrieved on 2018-01-07.
- ^ «Cubas Nickel Production Exceeds 50000 metric tons». Cuba Business Report. Retrieved 18 April 2021.
- ^
Donachie, Matthew J. (2002). Superalloys: A Technical Guide. ASM International. ISBN 978-0-87170-749-9. - ^ Campbell, Flake C (2008-06-30). «Cobalt and Cobalt Alloys». Elements of metallurgy and engineering alloys. pp. 557–558. ISBN 978-0-87170-867-0.
- ^ Michel, R.; Nolte, M.; Reich M.; Löer, F. (1991). «Systemic effects of implanted prostheses made of cobalt-chromium alloys». Archives of Orthopaedic and Trauma Surgery. 110 (2): 61–74. doi:10.1007/BF00393876. PMID 2015136. S2CID 28903564.
- ^ Disegi, John A. (1999). Cobalt-base Aloys for Biomedical Applications. ASTM International. p. 34. ISBN 0-8031-2608-5.
- ^ Luborsky, F. E.; Mendelsohn, L. I.; Paine, T. O. (1957). «Reproducing the Properties of Alnico Permanent Magnet Alloys with Elongated Single-Domain Cobalt-Iron Particles». Journal of Applied Physics. 28 (344): 344. Bibcode:1957JAP….28..344L. doi:10.1063/1.1722744.
- ^ Biggs, T.; Taylor, S. S.; Van Der Lingen, E. (2005). «The Hardening of Platinum Alloys for Potential Jewellery Application». Platinum Metals Review. 49: 2–15. doi:10.1595/147106705X24409.
- ^ a b c
Hawkins, M. (2001). «Why we need cobalt». Applied Earth Science. 110 (2): 66–71. Bibcode:2001AdEaS.110…66H. doi:10.1179/aes.2001.110.2.66. S2CID 137529349. - ^ a b
Armstrong, R. D.; Briggs, G. W. D.; Charles, E. A. (1988). «Some effects of the addition of cobalt to the nickel hydroxide electrode». Journal of Applied Electrochemistry. 18 (2): 215–219. doi:10.1007/BF01009266. S2CID 97073898. - ^
Zhang, P.; Yokoyama, Toshiro; Itabashi, Osamu; Wakui, Yoshito; Suzuki, Toshishige M.; Inoue, Katsutoshi (1999). «Recovery of metal values from spent nickel–metal hydride rechargeable batteries». Journal of Power Sources. 77 (2): 116–122. Bibcode:1999JPS….77..116Z. doi:10.1016/S0378-7753(98)00182-7. - ^ West, Karl (29 July 2017). «Carmakers’ electric dreams depend on supplies of rare minerals». The Guardian. eISSN 1756-3224. ISSN 0261-3077. OCLC 60623878. Archived from the original on 6 June 2022. Retrieved 29 June 2022.
- ^ Castellano, Robert (13 October 2017). «How To Minimize Tesla’s Cobalt Supply Chain Risk». Seeking Alpha. Archived from the original on 4 April 2022. Retrieved 29 June 2022.
- ^ a b «As Cobalt Supply Tightens, LiCo Energy Metals Announces Two New Cobalt Mines». cleantechnica.com. 2017-11-28. Retrieved 2018-01-07.
- ^ Shilling, Erik (31 October 2017). «We May Not Have Enough Minerals To Even Meet Electric Car Demand». Jalopnik. Archived from the original on 1 April 2022. Retrieved 29 June 2022.
- ^ «State of Charge: EVs, Batteries and Battery Materials (Free Report from @AdamasIntel)». Adamas Intelligence. 20 September 2019. Archived from the original on 20 October 2019. Retrieved 20 October 2019.
- ^ «Muskmobiles running rivals off the road». MINING.COM. 26 September 2019. Archived from the original on 2019-09-30.
- ^ «Electric car future may depend on deep sea mining». BBC News. 13 November 2019.
- ^
Hermes, Jennifer. (2017-05-31) Tesla & GE Face Major Shortage Of Ethically Sourced Cobalt. Environmentalleader.com. Retrieved on 2018-01-07. - ^ Electric cars yet to turn cobalt market into gold mine – Nornickel. MINING.com (2017-10-30). Retrieved on 2018-01-07.
- ^ «Why Have Cobalt Prices Crashed». International Banker. 31 July 2019. Archived from the original on 2019-11-30.
- ^ «Cobalt Prices and Cobalt Price Charts — InvestmentMine». www.infomine.com.
- ^ «Tesla joins «Fair Cobalt Alliance» to improve DRC artisanal mining». mining-technology.com. 2020-09-08. Retrieved 2020-09-26.
- ^ Klender, Joey (2020-09-08). «Tesla joins Fair Cobalt Alliance in support of moral mining efforts». teslarati.com. Retrieved 2020-09-26.
- ^ CObalt-free Batteries for FutuRe Automotive Applications website
- ^ COBRA project at European Union
- ^ Yoo-chul, Kim (2020-08-14). «Tesla’s battery strategy, implications for LG and Samsung». koreatimes.co.kr. Retrieved 2020-09-26.
- ^ Shahan, Zachary (2020-08-31). «Lithium & Nickel & Tesla, Oh My!». cleantechnica.com. Retrieved 2020-09-26.
- ^ Calma, Justine (2020-09-22). «Tesla to make EV battery cathodes without cobalt». theverge.com. Retrieved 2020-09-26.
- ^ «Cobalt Drier for Paints | Cobalt Cem-All®». Borchers. Retrieved 2021-05-15.
- ^ Weatherhead, R. G. (1980), Weatherhead, R. G. (ed.), «Catalysts, Accelerators and Inhibitors for Unsaturated Polyester Resins», FRP Technology: Fibre Reinforced Resin Systems, Dordrecht: Springer Netherlands, pp. 204–239, doi:10.1007/978-94-009-8721-0_10, ISBN 978-94-009-8721-0, retrieved 2021-05-15
- ^ «The product selector | AOC». aocresins.com. Retrieved 2021-05-15.
- ^ «Comar Chemicals — Polyester Acceleration». www.comarchemicals.com. Archived from the original on 2021-05-15. Retrieved 2021-05-15.
- ^
Khodakov, Andrei Y.; Chu, Wei & Fongarland, Pascal (2007). «Advances in the Development of Novel Cobalt Fischer-Tropsch Catalysts for Synthesis of Long-Chain Hydrocarbons and Clean Fuels». Chemical Reviews. 107 (5): 1692–1744. doi:10.1021/cr050972v. PMID 17488058. - ^
Hebrard, Frédéric & Kalck, Philippe (2009). «Cobalt-Catalyzed Hydroformylation of Alkenes: Generation and Recycling of the Carbonyl Species, and Catalytic Cycle». Chemical Reviews. 109 (9): 4272–4282. doi:10.1021/cr8002533. PMID 19572688. - ^
Overman, Frederick (1852). A treatise on metallurgy. D. Appleton & company. pp. 631–637. - ^
Muhlethaler, Bruno; Thissen, Jean; Muhlethaler, Bruno (1969). «Smalt». Studies in Conservation. 14 (2): 47–61. doi:10.2307/1505347. JSTOR 1505347. - ^
Gehlen, A. F. (1803). «Ueber die Bereitung einer blauen Farbe aus Kobalt, die eben so schön ist wie Ultramarin. Vom Bürger Thenard». Neues Allgemeines Journal der Chemie, Band 2. H. Frölich. (German translation from L. J. Thénard; Journal des Mines; Brumaire 12 1802; p 128–136) - ^
Witteveen, H. J.; Farnau, E. F. (1921). «Colors Developed by Cobalt Oxides». Industrial & Engineering Chemistry. 13 (11): 1061–1066. doi:10.1021/ie50143a048. - ^
Venetskii, S. (1970). «The charge of the guns of peace». Metallurgist. 14 (5): 334–336. doi:10.1007/BF00739447. S2CID 137225608. - ^
Mandeville, C.; Fulbright, H. (1943). «The Energies of the γ-Rays from Sb122, Cd115, Ir192, Mn54, Zn65, and Co60«. Physical Review. 64 (9–10): 265–267. Bibcode:1943PhRv…64..265M. doi:10.1103/PhysRev.64.265. - ^
Wilkinson, V. M; Gould, G (1998). Food irradiation: a reference guide. p. 53. ISBN 978-1-85573-359-6. - ^
Blakeslee, Sandra (1984-05-01). «The Juarez accident». The New York Times. Retrieved 2009-06-06. - ^
«Ciudad Juarez orphaned source dispersal, 1983». Wm. Robert Johnston. 2005-11-23. Retrieved 2009-10-24. - ^
National Research Council (U.S.). Committee on Radiation Source Use and Replacement; National Research Council (U.S.). Nuclear and Radiation Studies Board (January 2008). Radiation source use and replacement: abbreviated version. National Academies Press. pp. 35–. ISBN 978-0-309-11014-3. Retrieved 2011-04-29. - ^
Meyer, Theresa (2001-11-30). Physical Therapist Examination Review. p. 368. ISBN 978-1-55642-588-2. - ^
Kalnicky, D.; Singhvi, R. (2001). «Field portable XRF analysis of environmental samples». Journal of Hazardous Materials. 83 (1–2): 93–122. doi:10.1016/S0304-3894(00)00330-7. PMID 11267748. - ^
Payne, L. R. (1977). «The Hazards of Cobalt». Occupational Medicine. 27 (1): 20–25. doi:10.1093/occmed/27.1.20. PMID 834025. - ^
Puri-Mirza, Amna (2020). «Morocco Cobalt Production». Statistica. - ^ Davis, Joseph R; Handbook Committee, ASM International (2000-05-01). «Cobalt». Nickel, cobalt, and their alloys. p. 354. ISBN 978-0-87170-685-0.
- ^ Committee On Technological Alternatives For Cobalt Conservation, National Research Council (U.S.); National Materials Advisory Board, National Research Council (U.S.) (1983). «Ground–Coat Frit». Cobalt conservation through technological alternatives. p. 129.
- ^ Yamada, Kazuhiro (2013). «Chapter 9. Cobalt: Its Role in Health and Disease». In Astrid Sigel; Helmut Sigel; Roland K. O. Sigel (eds.). Interrelations between Essential Metal Ions and Human Diseases. Metal Ions in Life Sciences. Vol. 13. Springer. pp. 295–320. doi:10.1007/978-94-007-7500-8_9. PMID 24470095.
- ^
Cracan, Valentin; Banerjee, Ruma (2013). «Chapter 10 Cobalt and Corrinoid Transport and Biochemistry». In Banci, Lucia (ed.). Metallomics and the Cell. Metal Ions in Life Sciences. Vol. 12. Springer. pp. 333–374. doi:10.1007/978-94-007-5561-1_10. ISBN 978-94-007-5560-4. PMID 23595677. electronic-book ISBN 978-94-007-5561-1 ISSN 1559-0836 electronic-ISSN 1868-0402. - ^ Schwarz, F. J.; Kirchgessner, M.; Stangl, G. I. (2000). «Cobalt requirement of beef cattle – feed intake and growth at different levels of cobalt supply». Journal of Animal Physiology and Animal Nutrition. 83 (3): 121–131. doi:10.1046/j.1439-0396.2000.00258.x.
- ^ Voet, Judith G.; Voet, Donald (1995). Biochemistry. New York: J. Wiley & Sons. p. 675. ISBN 0-471-58651-X. OCLC 31819701.
- ^ Smith, David M.; Golding, Bernard T.; Radom, Leo (1999). «Understanding the Mechanism of B12-Dependent Methylmalonyl-CoA Mutase: Partial Proton Transfer in Action». Journal of the American Chemical Society. 121 (40): 9388–9399. doi:10.1021/ja991649a.
- ^ Kobayashi, Michihiko; Shimizu, Sakayu (1999). «Cobalt proteins». European Journal of Biochemistry. 261 (1): 1–9. doi:10.1046/j.1432-1327.1999.00186.x. PMID 10103026.
- ^ «Soils». Waikato University. Archived from the original on 2012-01-25. Retrieved 2012-01-16.
- ^ a b McDowell, Lee Russell (2008). Vitamins in Animal and Human Nutrition (2nd ed.). Hoboken: John Wiley & Sons. p. 525. ISBN 978-0-470-37668-3.
- ^ Australian Academy of Science > Deceased Fellows > Hedley Ralph Marston 1900–1965 Accessed 12 May 2013.
- ^ Snook, Laurence C. (1962). «Cobalt: its use to control wasting disease». Journal of the Department of Agriculture, Western Australia. 4. 3 (11): 844–852.
- ^ «Cobalt 356891». Sigma-Aldrich. 2021-10-14. Retrieved 2021-12-22.
- ^ Donaldson, John D. and Beyersmann, Detmar (2005) «Cobalt and Cobalt Compounds» in Ullmann’s Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim. doi:10.1002/14356007.a07_281.pub2
- ^ NIOSH Pocket Guide to Chemical Hazards. «#0146». National Institute for Occupational Safety and Health (NIOSH).
- ^ Morin Y; Tětu A; Mercier G (1969). «Quebec beer-drinkers’ cardiomyopathy: Clinical and hemodynamic aspects». Annals of the New York Academy of Sciences. 156 (1): 566–576. Bibcode:1969NYASA.156..566M. doi:10.1111/j.1749-6632.1969.tb16751.x. PMID 5291148. S2CID 7422045.
- ^ Barceloux, Donald G. & Barceloux, Donald (1999). «Cobalt». Clinical Toxicology. 37 (2): 201–216. doi:10.1081/CLT-100102420. PMID 10382556.
- ^ [PDF]
- ^ Elbagir, Nima; van Heerden, Dominique; Mackintosh, Eliza (May 2018). «Dirty Energy». CNN. Retrieved 30 May 2018.
- ^ Basketter, David A.; Angelini, Gianni; Ingber, Arieh; Kern, Petra S.; Menné, Torkil (2003). «Nickel, chromium and cobalt in consumer products: revisiting safe levels in the new millennium». Contact Dermatitis. 49 (1): 1–7. doi:10.1111/j.0105-1873.2003.00149.x. PMID 14641113. S2CID 24562378.
Further reading[edit]
- Harper, E. M.; Kavlak, G.; Graedel, T. E. (2012). «Tracking the metal of the goblins: Cobalt’s cycle of use». Environmental Science & Technology. 46 (2): 1079–86. Bibcode:2012EnST…46.1079H. doi:10.1021/es201874e. PMID 22142288. S2CID 206948482.
- Narendrula, R.; Nkongolo, K. K.; Beckett, P. (2012). «Comparative soil metal analyses in Sudbury (Ontario, Canada) and Lubumbashi (Katanga, DR-Congo)». Bulletin of Environmental Contamination and Toxicology. 88 (2): 187–92. doi:10.1007/s00128-011-0485-7. PMID 22139330. S2CID 34070357.
- Pauwels, H.; Pettenati, M.; Greffié, C. (2010). «The combined effect of abandoned mines and agriculture on groundwater chemistry». Journal of Contaminant Hydrology. 115 (1–4): 64–78. Bibcode:2010JCHyd.115…64P. doi:10.1016/j.jconhyd.2010.04.003. PMID 20466452.
- Bulut, G. (2006). «Recovery of copper and cobalt from ancient slag». Waste Management & Research. 24 (2): 118–24. doi:10.1177/0734242X06063350. PMID 16634226. S2CID 24931095.
- Jefferson, J. A.; Escudero, E.; Hurtado, M. E.; Pando, J.; Tapia, R.; Swenson, E. R.; Prchal, J.; Schreiner, G. F.; Schoene, R. B.; Hurtado, A.; Johnson, R. J. (2002). «Excessive erythrocytosis, chronic mountain sickness, and serum cobalt levels». Lancet. 359 (9304): 407–8. doi:10.1016/s0140-6736(02)07594-3. PMID 11844517. S2CID 12319751.
- Løvold, T. V.; Haugsbø, L. (1999). «Cobalt mining factory—diagnoses 1822-32». Tidsskrift for den Norske Laegeforening. 119 (30): 4544–6. PMID 10827501.
- Bird, G. A.; Hesslein, R. H.; Mills, K. H.; Schwartz, W. J.; Turner, M. A. (1998). «Bioaccumulation of radionuclides in fertilized Canadian Shield lake basins». The Science of the Total Environment. 218 (1): 67–83. Bibcode:1998ScTEn.218…67B. doi:10.1016/s0048-9697(98)00179-x. PMID 9718743.
- Nemery, B. (1990). «Metal toxicity and the respiratory tract». The European Respiratory Journal. 3 (2): 202–19. doi:10.1183/09031936.93.03020202. PMID 2178966.
- Kazantzis, G. (1981). «Role of cobalt, iron, lead, manganese, mercury, platinum, selenium, and titanium in carcinogenesis». Environmental Health Perspectives. 40: 143–61. doi:10.1289/ehp.8140143. PMC 1568837. PMID 7023929.
- Kerfoot, E. J.; Fredrick, W. G.; Domeier, E. (1975). «Cobalt metal inhalation studies on miniature swine». American Industrial Hygiene Association Journal. 36 (1): 17–25. doi:10.1080/0002889758507202. PMID 1111264.
External links[edit]
![]()
Wikimedia Commons has media related to Cobalt.
![]()
Look up cobalt in Wiktionary, the free dictionary.
- Cobalt at The Periodic Table of Videos (University of Nottingham)
- Centers for Disease and Prevention – Cobalt
- The Cobalt Institute
- Responsible Cobalt Institute Archived 2021-03-07 at the Wayback Machine
В Саксонии с давних времен добывали цветные металлы. Частенько горняки добывали казалось бы серебряную руду, но выплавить серебро не получалось. А при плавке руда выделяла газ, от которого травились рабочие. Такую «нечистую» руду шахтеры называли «кобольд». Считалось, что злые духи подземелий (кобольды) вредят шахтерам, прячут хорошую руду и подсовывают ядовитую.
Отсюда и происхождение названия — кобальт. В этом случае никель и наш герой — родные братья. Оба получили названия от языческих горных духов.
Содержание
- 1 Кто нашел «вредного духа»
- 2 Свойства металла
- 3 Месторождения кобальтсодержащих руд
- 4 Детский труд на богатейших шахтах
- 5 Получение и марки кобальта
- 6 Чем хорош и плох кобальт
- 7 Применение металла: инструменты, краски, электроника
- 7.1 Синий, желтый, фиолетовый…
- 7.2 От кобальтовой пушки до домика в деревне
- 7.3 Вперед, к электромобилю
- 7.4 Наши любимые кошки: зачем им наш герой?
- 8 Сплавляем металлы
- 9 Цена металла на LME
Кто нашел «вредного духа»
История открытия проста. Георг Брандт, шведский химик и минералог (по совместительству начальник Шведского королевского монетного двора) любил мышьяк. Не в смысле гастрономическом, а как ученый. Но в ходе исследований любимого элемента ученый нашел методы получения некоторых металлов, разработал способы получения основных кислот (серной, азотной, соляной). А еще определил, что за вредный дух мешает добывать серебро горнякам.

В руде имелся неизвестный раньше элемент, его Брандт назвал кобальтом. Еще химик выяснил, что соли найденного металла окрашивают стекло в восхитительный синий цвет.
Познавательно: в незапамятные времена в центрах цивилизаций (Египте, Вавилоне) делали стекло и смальту синего цвета.
Мартин Руланд, немецкий врач и алхимик, работавший при дворе императора Рудольфа II, в своем «Алхимическом лексиконе» писал:
«Кобальт (Koboltum, Kobaltum) или коллет (Colletum) … черная, немного похожая по цвету на золу материя, которую можно ковать и лить, она не обладает металлическим блеском, и представляет собой вредную взвесь, уводящую (при плавке) вместе с дымом хорошую руду». Очевидно, здесь говорится о металлическом кобальте.
Свойства металла
Кобальт — элемент периодической таблицы Менделеева под номером 27. Его относят к металлам, он имеет белый или желтоватый серебристый цвет. Имеет синеватый или розоватый отлив.
Физические свойства металла:
- плотность 8,9 г/см³;
- температура плавления 1495°С;
- кипит при 2870 градусах Цельсия;
Кобальт ферромагнетик, как и два его соседа по таблице Менделеева — железо и никель.
Химические свойства металла обусловлены его степенями окисления — +2, +3, 0.
Холодная концентрированная азотная кислота пассивирует Co.
Щелочи реагируют с водными растворами солей, при этом образуется гидроксид Со(ОН)2.
| Свойства атома | |
|---|---|
| Название, символ, номер | Кобальт / Cobaltum (Co), 27 |
| Атомная масса (молярная масса) | 58,933194(4) а. е. м. (г/моль) |
| Электронная конфигурация | [Ar] 3d7 4s2 |
| Радиус атома | 125 пм |
| Химические свойства | |
| Ковалентный радиус | 116 пм |
| Радиус иона | (+3e) 63 (+2e) 72 пм |
| Электроотрицательность | 1,88 (шкала Полинга) |
| Электродный потенциал | E0(Co2+/Co) = −0,277 В |
| Степени окисления | 3, 2, 0, −1 |
| Энергия ионизации (первый электрон) | 758,1 (7,86) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 8,9 г/см³ |
| Температура плавления | 1768 K |
| Температура кипения | 3143 K |
| Уд. теплота плавления | 15,48 кДж/моль |
| Уд. теплота испарения | 389,1 кДж/моль |
| Молярная теплоёмкость | 24,8[1] Дж/(K·моль) |
| Молярный объём | 6,7 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | гексагональная |
| Параметры решётки | a=2,505 c=4,089 Å |
| Отношение c/a | 1,632 |
| Температура Дебая | 385 K |
| Прочие характеристики | |
| Теплопроводность | (300 K) 100 Вт/(м·К) |
| Номер CAS | 7440-48-4 |
Водорастворимые соли кобальта дарят воде розовый цвет. Растворенные в ацетоне, эти соли окрашивают раствор в синий цвет.
Месторождения кобальтсодержащих руд
В природе нахождение таких руд вроде не проблема. Кобальтсодержащих минералов геологи насчитывают более 130. Вопрос в том, сколько именно металла содержит руда.

Собственно кобальтовых минералов всего около 40.
- Скуттерит. Содержание Cо до 30%.
- Саффлорит-лёллингит. Кобальта в руде до 29%.
- Арсенопирит-аллоклазит. В ней искомого металла до 35%
- Кобальтин-герсдорфит с содержанием Cо до 35%.
Но в большинстве кобальтсодержащие руды металла содержат до 3%.
Кобальт добывают из сернистых медно-никелевых, окисленных кобальто-медных, силикатно-оксидных никелевых месторождений.
Детский труд на богатейших шахтах
Конго — одна из беднейших и коррумпированных стран. Зато в ее недрах находятся бесценные сокровища. Страна занимает первое место в мире по добыче кобальта (около 60%). Добычу ведут в самодельных шахтах, практически руками и молотком. Треть из работающих в шахтах дети школьного возраста. За 12-ти часовой рабочий день малолетний работник получает 3-4 доллара США.

Остальные страны обделены этим ценным ресурсом:
- Канада — 6% мировой добычи кобальта.
- Австралия 4 %.
- Филиппины 4%.
- Куба 3%.
- Замбия 3%.
- Россия 3%.
Получение и марки кобальта
Получение нашего героя зависит от выплавки… меди и никеля. Наш герой — побочный продукт этих производств. Делается это методами пирометаллургии, выщелачиванием с последующей алюминотермией.
| Марка кобальта | Вид выпуска, содержание Co |
| К0 | не менее 99,98% Со |
| виталлиум | 62-65% Со |
| стеллита | 50% Со |
| викаллой | 52% Со |
| К2 | не менее 98,3% Со |
| ПК-1у | Порошок металлического кобальта, (Co не меньше 99,35%) |
Выпускается в виде проволоки, слитков, полос, пластин.
Чем хорош и плох кобальт
Достоинствам нашего героя позавидуют многие металлы.
- Отличная жаропрочность.
- Высокие твердость и устойчивость к износу (даже при высоких температурах).
- Устойчив к размагничиванию.
Недостаток практически один, но существенный — высокая цена.
Применение металла: инструменты, краски, электроника
Использование кобальта ограничено его ценой, иначе он применялся бы гораздо шире. Но в производстве инструментальных материалах металл необходим. Знаменитый советский сплав «победит» (помните, победитовые сверла) кроме кобальта содержит вольфрам.
Продукция из кобальта и его соединений — это сплавы с особыми свойствами, сердечники электромоторов и трансформаторов.
Квантовые генераторы и усилители, печатные схемы в радиоэлектронике, авиационная и космическая промышленности — везде отметился наш герой.
Не доказано: есть версия, что при аресте у Маты Хари (знаменитой куртизанки, танцовщицы и по совместительству шпионки) нашли пузырек с чернилами, содержащими соли кобальта. Эти чернила проявляют надпись на бумаге только при ее нагревании. Кстати, таким же свойством обладает молоко…
Такие «специальные шпионские» чернила обычному человеку не нужны. Это был повод арестовать Мату Хари.
Синий, желтый, фиолетовый…
Декорирование керамики и стекла началось еще в античные времена. Венеция с ее знаменитыми мастерами по стеклу использовала соли кобальта для окраски стеклянных изделий в глубокий синий цвет. И не только синий. Фосфорнокислая соль имеет фиолетовый цвет; соль Фишера — желтый; сульфат кобальта ярко-розового цвета, есть соль зеленая. Все эти соли применяют в производстве масляных красок и для росписи фарфоровых изделий.
Бесценные вазы, чаши, шкатулки эпохи Мин украшают крупнейшие музеи и редкие частные коллекции. Вся эта керамика украшена голубой росписью кобальтовых красок.
Познавательно: сохранился синий египетский кувшин (стекло окрашено солями кобальта). Кувшинчик сделали в ХV в. до нашей эры. Существуют и стекловидные голубые кирпичи, содержащие соли нашего героя.
От кобальтовой пушки до домика в деревне
Изотоп 60Co — источник гамма-излучения. У него довольно широкий спектр применения:
- В медицине «кобальтовая пушка» для лучевой терапии опухолей.
- В дефектоскопах.
- Для уничтожения насекомых в зерне.
- Для стерилизации инструментов.
Биологическая роль металла велика, но тут действует принцип «в капле лекарство, в ложке яд».
Наш герой — необходимый компонент витамина В-12, его недостаток вызывает болезни у людей и животных.
Препараты с кобальтом — необходимая составляющая комбикормов. Добавьте немного солей кобальта в любимый пруд, и получите хороший прирост рыбы.
Познавательно: в России велика площадь земель с пониженным содержанием металла кобальта. Если на такой земле стоит ваш домик в деревне, пасутся коровы и козы — не избежать проблем со здоровьем животных (и потребителей продуктов животноводства).
Применение кобальта в электронике необходимо. Батарейки, аккумуляторы, некоторые детали электроники невозможно сделать без кобальта.
Металлический порошок используют как катализатор при синтезе бензина, производстве маргаринов и спредов.
Вперед, к электромобилю
Автомобили с ДВС морально устарели, опасны в плане экологии. В общем, пора переходить на электромобили. Мешает массовому переходу на электромобили …кобальт. Вернее, литий-ионные аккумуляторы, где этот металл нужен, причем в немалых количествах. Правда, производители аккумуляторов ищут пути к уменьшению в них содержания драгоценного металла.
Аналитики считают, что лет через 20 треть автомобилей в мире будут работать на электричестве.
Наши любимые кошки: зачем им наш герой?
Им-то он точно не нужен. Нужен их хозяевам. Дорогие наполнители для кошачьих лотков (туалетов) содержат «индикатор влажности» — цветные кусочки соли двухвалентного кобальта. Его особенность — менять цвет с синего на розовый при увлажнении. То бишь, справила ваша кошечка малые дела в лоток, и индикаторные кусочки изменили цвет. Меняйте наполнитель.
Сплавляем металлы
В сверхлегированных никелевых сплавах наш герой занимает почетное место.
Для промышленности характеристики сплавов просто блестящие. Они бывают жаропрочными, износостойкими, сверхтвердые.

Сверхтвердые стеллитовые сплавы содержат кобальт и хром.
Как легирующая добавка наш герой входит в состав быстрорежущих инструментальных сталей, но в них целое содружество металлов:
- вольфрам 15-19%;
- кобальт 5-13%;
- хром 4%;
- ванадий 1%.
Дисперсионно закаленные сплавы нержавейки применяют для изготовления приводов, клапанов и в нефтяной промышленности.
Ферромагнитные свойства металла используют в сплавах с самарием. Кобальт-самариевые магниты имеют большую магнитную силу, чем ферритовые и могут работать при высоких температурах.
Цена металла на LME
Стоимость тонны кобальта на Лондонской бирже металлов составляет 29500,0 US$ (цена указана на 27.05.2020).
| Кобальт | |
|---|---|
| Блестящий, серебристо-белый металл | |
 | |
| Название, символ, номер | Кобальт / Cobaltum (Co), 27 |
| Атомная масса (молярная масса) | 58,933194(4) а. е. м. (г/моль) |
| Электронная конфигурация | [Ar] 3d7 4s2 |
| Радиус атома | 125 пм |
| Ковалентный радиус | 116 пм |
| Радиус иона | (+3e) 63 (+2e) 72 пм |
| Электроотрицательность | 1,88 (шкала Полинга) |
| Электродный потенциал | E0(Co2+/Co) = −0,277 В |
| Степени окисления | 3, 2, 0, −1 |
| Энергия ионизации (первый электрон) | 758,1 (7,86) кДж/моль (эВ) |
| Плотность (при н. у.) | 8,9 г/см³ |
| Температура плавления | 1768 K |
| Температура кипения | 3143 K |
| Уд. теплота плавления | 15,48 кДж/моль |
| Уд. теплота испарения | 389,1 кДж/моль |
| Молярная теплоёмкость | 24,8 Дж/(K·моль) |
| Молярный объём | 6,7 см³/моль |
| Структура решётки | гексагональная |
| Параметры решётки | a=2,505 c=4,089 Å |
| Отношение c/a | 1,632 |
| Температура Дебая | 385 K |
| Теплопроводность | (300 K) 100 Вт/(м·К) |
| Номер CAS | 7440-48-4 |
Кобальт — химический элемент с атомным номером 27. Принадлежит к 9-й группе периодической таблицы химических элементов (по устаревшей короткой форме периодической системы принадлежит к побочной подгруппе VIII группы, или к группе VIIIB), находится в четвёртом периоде таблицы. Атомная масса элемента 58,933194(4) а. е. м.. Обозначается символом Co (от лат. Cobaltum). Простое вещество кобальт — серебристо-белый, слегка желтоватый металл с розоватым или синеватым отливом. Существует в двух кристаллических модификациях: α-Co с гексагональной плотноупакованной решёткой, β-Co с кубической гранецентрированной решёткой, температура перехода α↔β 427 °C.
Содержание
- 1 Происхождение названия
- 2 История
- 3 Нахождение в природе
- 3.1 Месторождения
- 3.2 Получение
- 3.3 Стоимость металлического кобальта
- 4 Физические свойства
- 4.1 Изотопы
- 5 Химические свойства
- 5.1 Оксиды
- 5.2 Другие соединения
- 6 Применение
- 7 Биологическая роль
- 7.1 Токсикология
Происхождение названия
Название «кобальт» происходит от нем. Kobold — домовой, гном. При обжиге содержащих мышьяк кобальтовых минералов выделяется летучий ядовитый оксид мышьяка. Руда, содержащая эти минералы, получила у горняков имя горного духа Кобольда. Древние норвежцы приписывали отравления плавильщиков при переплавке серебра проделкам этого злого духа. В этом происхождение названия кобальта схоже с происхождением названия никеля.
В 1735 году шведский минералог Георг Брандт сумел выделить из этого минерала неизвестный ранее металл, который и назвал кобальтом. Он выяснил также, что соединения именно этого элемента окрашивают стекло в синий цвет — этим свойством пользовались ещё в древних Ассирии и Вавилоне.
История
Соединения кобальта известны человеку с глубокой древности. Синие кобальтовые стёкла, эмали, краски находят в гробницах Древнего Египта. Так, в гробнице Тутанхамона нашли много осколков синего кобальтового стекла; неизвестно, было ли приготовление стёкол и красок сознательным или случайным.
Первое приготовление синих красок относится к 1800 году.
Нахождение в природе
Массовая доля кобальта в земной коре 4⋅10−3%.
Кобальт входит в состав минералов: каролит CuCo2S4, линнеит Co3S4, кобальтин CoAsS, сферокобальтит CoCO3, смальтин CoAs2, скуттерудит (Co, Ni)As3 и других. Всего известно около 30 кобальтосодержащих минералов. Кобальту сопутствуют мышьяк, железо, никель, хром, марганец и медь.
Содержание в морской воде приблизительно (1,7)⋅10−10%.
Месторождения
Также есть богатые месторождения в Демократической Республике Конго (6 млн т.), Австралии (1 млн т.), Кубе (500 тыс. т.), Филиппинах (290 тыс. т.), Канаде (270 тыс. т.), Замбии (270 тыс. т.), России (250 тыс. т.), а также в США, Франции и Казахстане.
Получение
Кобальт получают в основном из никелевых руд, обрабатывая их растворами серной кислоты или аммиака. Также используются методы пирометаллургии.
Для отделения от близкого по свойствам никеля используется хлор, хлорат кобальта(II) (Co(ClO3)2) выпадает в осадок, а соединения никеля остаются в растворе.
Стоимость металлического кобальта
Из-за политической ситуации в бассейне реки Конго в конце 1970-х годов цена на кобальт за год поднялась на 2000 %.
На 15 января 2018 года стоимость кобальта на мировом рынке, по данным London Metal Exchange, составляет 75 000 долл./т.
Физические свойства
Кобальт — твёрдый металл, существующий в двух модификациях. При температурах от комнатной до 427 °C устойчива α-модификация. При температурах от 427 °C до температуры плавления (1494 °C) устойчива β-модификация кобальта (решётка кубическая гранецентрированная). Кобальт — ферромагнетик, точка Кюри 1121 °C. Желтоватый оттенок ему придаёт тонкий слой оксидов.
Изотопы
Основная статья: Изотопы кобальта
Кобальт имеет только один стабильный изотоп — 59Co (изотопная распространённость 100%). Известны ещё 22 радиоактивных изотопа кобальта. Искусственный изотоп кобальт-60 широко применяется как источник жесткого гамма-излучения для стерилизации, в медицине в гамма-ножах, гамма-дефектоскопии и т. п.
Химические свойства
Оксиды
- На воздухе кобальт окисляется при температуре выше 300 °C.
- Устойчивый при комнатной температуре оксид кобальта представляет собой сложный оксид Co3O4, имеющий структуру шпинели, в кристаллической структуре которого одна часть узлов занята ионами Co2+, а другая — ионами Co3+; разлагается с образованием CoO при температуре выше 900 °C.
- При высоких температурах можно получить α-форму или β-форму оксида CoO.
- Все оксиды кобальта восстанавливаются водородом:
-
- Co3O4 + 4H2 → 3Co + 4H2O
- Оксид кобальта(III) можно получить, прокаливая соединения кобальта (II), например:
-
- 4Co(OH)2 + O2 → 2Co2O3 + 4H2O


Минерал с кобальтом
Другие соединения
- При нагревании кобальт реагирует с галогенами, причём соединения кобальта (III) образуются только с фтором.
-
- 2Co + 3F2 → 2CoF3
- Co + Cl2 → CoCl2
- С серой кобальт образует 2 различных модификации CoS. Серебристо-серую α-форму (при сплавлении порошков) и чёрную β-форму (выпадает в осадок из растворов).
- При нагревании CoS в атмосфере сероводорода получается сложный сульфид Co9S8.
- С другими окисляющими элементами, такими, как углерод, фосфор, азот, селен, кремний, бор, кобальт тоже образует сложные соединения, являющиеся смесями, где присутствует кобальт со степенями окисления 1, 2, 3.
- Кобальт способен растворять водород, не образуя химических соединений. Косвенным путём синтезированы два стехиометрических гидрида кобальта CoH2 и CoH.
- Растворы солей кобальта CoSO4, CoCl2, Со(NO3)2 придают воде бледно-розовую окраску, поскольку в водных растворах ион Co2+ существует в виде аквакомплексов [Co(H2O)6]2+ розового цвета. Растворы солей кобальта в спиртах тёмно-синие. Многие соли кобальта нерастворимы.
- Кобальт образует комплексные соединения. В степени окисления +2 кобальт образует лабильные комплексы, в то время как в степени окисления +3 — очень инертные. Это приводит к тому, что комплексные соединения кобальта(III) практически невозможно получить путём непосредственного обмена лигандов, поскольку такие процессы идут чрезвычайно медленно. Наиболее известны аминокомплексы кобальта.
Наиболее устойчивыми комплексами являются лутеосоли (например, [Co(NH3)6]3+) жёлтого цвета и розеосоли (например, [Co(NH3)5H2O]3+) красного или розового цвета.
- Также кобальт образует комплексы с CN−, NO2− и многими другими лигандами. Комплексный анион гексанитрокобальтат [Co(NO2)6]3− образует нерастворимый осадок с катионами калия, что используется в качественном анализе.
Применение
- Специальные сплавы и стали — главное применение кобальта.
- Легирование стали кобальтом повышает её твердость, износо- и жаростойкость. Из кобальтовых сталей создают обрабатывающий инструмент: свёрла, резцы, и т. п.
- Сплавы кобальта и хрома получили собственное название стеллит. Они обладают высокой твёрдостью и износостойкостью. Также благодаря коррозионной стойкости и биологической нейтральности некоторые стеллиты применяются в протезировании
- Некоторые сплавы кобальта, например, с самарием или эрбием, проявляют высокую остаточную намагниченность, то есть они пригодны для изготовления мощных жаростойких постоянных магнитов (см. Самариево-кобальтовый магнит. Также в качестве магнитов используют сплавы на основе железа и алюминия с кобальтом, например альнико.
- Кобальт применяется при изготовлении химически стойких сплавов.
- Кобальт и его соединения применяются в никель-кадмиевых и некоторых конструкциях литий-ионных аккумуляторов.
- Соединения кобальта широко применяются для получения ряда красок и при окраске стекла и керамики. Например, тенарова синь.
- Кобальт применяется как катализатор химических реакций в нефтехимии, промышленности полимеров и других процессах.
- Силицид кобальта — отличный термоэлектрический материал, он позволяет производить термоэлектрогенераторы с высоким КПД.
- Искусственный изотоп кобальт-60 широко применяется как источник жёсткого гамма-излучения для стерилизации, в медицине в гамма-ножах, гамма-дефектоскопии, облучении продуктов питания и т. п.

Биологическая роль
Кобальт — один из микроэлементов, жизненно важных организму. Он входит в состав витамина B12 (кобаламин). Кобальт задействован при кроветворении, функциях нервной системы и печени, ферментативных реакциях. Потребность человека в кобальте — 0,007—0,015 мг ежедневно. В теле человека содержится 0,2 мг кобальта на каждый килограмм массы тела. При отсутствии кобальта развивается акобальтоз.
Токсикология

Кобальт и его соединения токсичны. Известны также соединения, обладающие канцерогенным и мутагенным действием (например, сульфат).
В 1960-х годах соли кобальта использовались некоторыми пивоваренными компаниями для стабилизации пены. Регулярно выпивавшие более четырёх литров пива в день получали серьёзные побочные эффекты на сердце, и, в отдельных случаях, это приводило к смерти. Известные случаи т. н. кобальтовой кардиомиопатии в связи с употреблением пива происходили с 1964 по 1966 годы в Омахе (штат Небраска), Квебеке (Канада), Левене (Бельгия), и Миннеаполисе (штат Миннесота). С тех пор его использование в пивоварении прекращено и в настоящее время является незаконным.
ПДК пыли кобальта в воздухе 0,5 мг/м³, в питьевой воде допустимое содержание солей кобальта 0,01 мг/л.
Токсическая доза (LD50 для крыс) — 50 мг.
Особенно токсичны пары октакарбонила кобальта Co2(СО)8.
| Периодическая система химических элементов Д. И. Менделеева | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
| Электрохимический ряд активности металлов |
|---|
| Eu, Sm, Li, Cs, Rb, K, Ra, Ba, Sr, Ca, Na, Ac, La, Ce, Pr, Nd, Pm, Gd, Tb, Mg, Y, Dy, Am, Ho, Er, Tm, Lu, Sc, Pu, |
Кобальт в таблице менделеева занимает 27 место, в 4 периоде.
| Символ | Co |
| Номер | 27 |
| Атомный вес | 58.9331940 |
| Латинское название | Cobaltum |
| Русское название | Кобальт |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема кобальта
Co: 1s2 2s2 2p6 3s2 3p6 4s2 3d7
Короткая запись:
Co: [Ar]4s2 3d7
Одинаковую электронную конфигурацию имеют
атом кобальта и
Mn-2, Fe-1, Ni+1
Порядок заполнения оболочек атома кобальта (Co) электронами:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d →
5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ — до 6, на
‘d’ — до 10 и на ‘f’ до 14
Кобальт имеет 27 электронов,
заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
6 электронов на 3p-подуровне
2 электрона на 4s-подуровне
7 электронов на 3d-подуровне
Степень окисления кобальта
Атомы кобальта в соединениях имеют степени окисления 5, 4, 3, 2, 1, 0, -1.
Степень окисления — это условный заряд атома в соединении: связь в молекуле
между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается
заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается,
то степень окисления положительная.
Ионы кобальта
Валентность Co
Атомы кобальта в соединениях проявляют валентность V, IV, III, II, I.
Валентность кобальта характеризует способность атома Co к образованию хмических связей.
Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании
химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Co
Квантовые числа определяются последним электроном в конфигурации,
для атома Co эти числа имеют значение N = 3, L = 2, Ml = -1, Ms = -½
Видео заполнения электронной конфигурации (gif):
Результат:

Энергия ионизации
Чем ближе электрон к центру атома — тем больше энергии необходимо, что бы его оторвать.
Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo.
Если не указано иное, то энергия ионизации — это энергия отрыва первого электрона, также существуют энергии
ионизации для каждого последующего электрона.
Энергия ионизации Co:
Eo = 760 кДж/моль
— Что такое ион читайте в статье.
Перейти к другим элементам таблицы менделеева
Где Co в таблице менделеева?
Таблица Менделеева
Скачать таблицу менделеева в хорошем качестве
Содержание
- Кобальт — 27 элемент таблицы Менделеева
- Происхождение названия
- История
- Основные сведения
- Свойства металла
- Физические и механические свойства
- Химические свойства
- Оксиды
- Другие соединения
- Термодинамические свойства простого вещества
- Кристаллическая решётка простого вещества
- Электронная схема кобальта
- Степень окисления кобальта
- Ионы кобальта
- Технология получения
- Нахождение в природе
- Получение и марки кобальта
- Достоинства и недостатки
- Области применения
- Кобальт в космосе
- Кобальт в промышленности
- Как можно отравиться кобальтом?
- Аллергия на кобальт в стоматологии
- Детский труд на богатейших шахтах
Кобальт — 27 элемент таблицы Менделеева
Кобальт — элемент побочной подгруппы восьмой группы четвёртого периода периодической системы химических элементов Д. И. Менделеева, атомный номер 27. Обозначается символом Co (лат. Cobaltum).
Атомный номер — 27 Атомная масса — 58,933 Плотность, кг/м³ — 8900 Температура плавления, °С — 1495 Теплоемкость, кДж/(кг·°С) — 0,414 Электроотрицательность — 1,8 Ковалентный радиус, Å — 1,16 1-й ионизац. потенциал, эв — 7,86
Соединения кобальта (англ. Cobalt, франц. Cobalt, нем. Kobalt) были известны и применялись в глубокой древности. Сохранился египетский стеклянный кувшин, относящийся к ХV в. до н.э., окрашенный солями кобальта, а также голубые стекловидные кирпичи, содержащие кобальт. В древней Ассирии, а также в Вавилоне из кобальта изготовляли лазурит — голубую краску, которой обливали керамические изделия. Вероятно, исходным материалом для получения кобальтовых соединений служил тогда цаффер (Zaffer) — сапфир, содержащий висмут и кобальт; откуда, по-видимому, и произошли названия красок — сафлор, шафран и др. В средние века горняки находили вместе с другими рудами кобальтовую «землю», но не знали, что с ней делать. Иногда эта земля была похожа на серебряную руду, но не содержала никакого серебра. Примесь кобальтовой земли к другим рудам мешала выплавке металлов: с образующимся густым дымом (сульфидов и арсенидов) терялась часть выплавляемого металла. Еще в IV в. у Псевдодемокрита и других авторов встречаются слова, означающие дым, образующийся при обжигании руд, содержащих сульфиды мышьяка. В средние века немецкие горняки,очевидно, желая подчеркнуть свойства кобальтовых земель, называли их коб-ольд (или кобельт), что означало подземный гном, насмешливый дух, бессовестный плут. В древнерусском языке имеются близкие по смыслу слова кобение (гадание), кобь (гадание по птичьему полету); последнее слово интересно сравнить с современным названием птицы — кобчик.

Происхождение названия
Название «кобальт» происходит от нем. Kobold — домовой, гном. При обжиге содержащих мышьяк кобальтовых минералов выделяется летучий ядовитый оксид мышьяка. Руда, содержащая эти минералы, получила у горняков имя горного духа Кобольда. Древние норвежцы приписывали отравления плавильщиков при переплавке серебра проделкам этого злого духа. В этом происхождение названия кобальта схоже с происхождением названия никеля.
В 1735 году шведский минералог Георг Брандт сумел выделить из этого минерала неизвестный ранее металл, который и назвал кобальтом. Он выяснил также, что соединения именно этого элемента окрашивают стекло в синий цвет — этим свойством пользовались ещё в древних Ассирии и Вавилоне.
История
Соединения кобальта известны человеку с глубокой древности. Синие кобальтовые стёкла, эмали, краски находят в гробницах Древнего Египта. Так, в гробнице Тутанхамона нашли много осколков синего кобальтового стекла; неизвестно, было ли приготовление стёкол и красок сознательным или случайным.
Первое приготовление синих красок относится к 1800 году.
Основные сведения
Кобальт (Co) (Cobaltum) — химический элемент VIII группы в периодической системе химических элементов с атомным номером 27, твердый вязкий блестящий голубовато-серый металл, относится к тяжелым металлам. Плотность равна 8,9 г/см3, tпл.=1493 °C, tкип.=2957 °C. В земной коре содержание Co равно 4·10-3% по массе. Данный металл входит в состав более 30 минералов. К ним относятся каролит CuCo2S4, линнеит Co3S4, кобальтин CoAsS, сферокобальтит CoCO3, смальтит СоAs2 и другие. В морской воде приблизительно (1-7)·10-10% Co.
Кобальт — элемент периодической таблицы Менделеева под номером 27. Его относят к металлам, он имеет белый или желтоватый серебристый цвет. Имеет синеватый или розоватый отлив.
Физические свойства металла:
- плотность 8,9 г/см³;
- температура плавления 1495°С;
- кипит при 2870 градусах Цельсия;
Кобальт ферромагнетик, как и два его соседа по таблице Менделеева — железо и никель.
Химические свойства металла обусловлены его степенями окисления — +2, +3, 0.
Холодная концентрированная азотная кислота пассивирует Co.
Щелочи реагируют с водными растворами солей, при этом образуется гидроксид Со(ОН)2.
Физические и механические свойства
Свойство Значение
| Атомный номер | 27 |
| Атомная масса, а.е.м | 58,93 |
| Атомный диаметр, пм | 250 |
| Плотность, г/см³ | 8,9 |
| Удельная теплоемкость, Дж/(K·моль) | 0,456 |
| Теплопроводность, Вт/(м·K) | 100 |
| Температура плавления, °С | 1493 |
| Температура кипения, °С | 2957 |
| Теплота плавления, кДж/моль | 15,48 |
| Теплота испарения, кДж/моль | 389,1 |
| Молярный объем, см³/моль | 6,7 |
| Группа металлов | Тяжелый металл |
Химические свойства
Свойство Значение
| Ковалентный радиус: | 130 пм |
| Радиус иона: | (+6e) 62 (+4e) 70 пм |
| Электроотрицательность (по Полингу): | 2,16 |
| Электродный потенциал: | |
| Степени окисления: | 6, 5, 4, 3, 2 |
Оксиды
- На воздухе кобальт окисляется при температуре выше 300 °C.
- Устойчивый при комнатной температуре оксид кобальта состоит из смеси оксидов CoO и Co2O3, поэтому в справочниках можно встретить брутто формулу Co3O4.
- При высоких температурах можно получить α-форму или β-форму оксида CoO
- Все оксиды кобальта восстанавливаются водородом. Со3О4 + 4Н2 → 3Со + 4Н2О.
- Оксид кобальта (II) можно получить, прокаливая соединения кобальта (II), например: 2Со(ОН)2 + O2 → Co2O3 + Н2O.
Другие соединения
- При нагревании, кобальт реагирует с галогенами, причём соединения кобальта (III) образуются только с фтором. Co + 3F → CoF3, но, Co + 2Cl → CoCl2
- С серой кобальт образует 2 различных модификации CoS. Серебристо-серую α-форму (при сплавлении порошков) и черную β-форму (выпадает в осадок из растворов).
- При нагревании CoS в атмосфере сероводорода получается сложный сульфид Со9S8
- С другими окисляющими элементами, такими как углерод, фосфор, азот, селен, кремний, бор. кобальт тоже образует сложные соединения, являющиеся смесями где присутствует кобальт со степенями окисления 1, 2, 3.
- Кобальт способен растворять водород, не образуя химических соединений. Косвенным путем синтезированы два стехиометрических гидрида кобальта СоН2 и СоН.
- Растворы солей кобальта CoSO4, CoCl2, Со(NO3)2 придают воде бледно-розовую окраску. Растворы солей кобальта в спиртах темно-синие. Многие соли кобальта нерастворимы.
- Кобальт создаёт комплексные соединения. Чаще всего на основе аммиака.
Наиболее устойчивыми комплексами являются лутеосоли [Co(NH3)6]3+ желтого цвета и розеосоли [Co(NH3)5H2O]3+ красного или розового цвета.
- Также кобальт создаёт комплексы на основе CN−, NO2− и многих других.
- Хлорид кобальта
- Ионные комплексы кобальта
Термодинамические свойства простого вещества
8,9 г/см³ — Плотность (при н. у.)
1768 K — Температура плавления
3143 K — Температура кипения
15,48 кДж/моль — Уд. теплота плавления
389,1 кДж/моль — Уд. теплота испарения
24,8 Дж/(K·моль) — Молярная теплоёмкость
6,7 см³/моль — Молярный объём
Кристаллическая решётка простого вещества
гексагональная — Структура решётки
a=2,505 c=4,089 Å — Параметры решётки
1,632 — Отношение c/a
385 K — Температура Дебая
Электронная схема кобальта
Co: 1s2 2s2 2p6 3s2 3p6 4s2 3d7
Короткая запись:
Co: [Ar]4s2 3d7
Одинаковую электронную конфигурацию имеют атом кобальта и -2Mn, -1Fe, +1Ni
Порядок заполнения оболочек атома кобальта (Co) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ — до 6, на ‘d’ — до 10 и на ‘f’ до 14
Кобальт имеет 27 электронов, заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
6 электронов на 3p-подуровне
2 электрона на 4s-подуровне
7 электронов на 3d-подуровне
Степень окисления кобальта
Атомы кобальта в соединениях имеют степени окисления 5, 4, 3, 2, 1, 0, -1.
Степень окисления — это условный заряд атома в соединении: связь в молекуле между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается, то степень окисления положительная.

Ионы кобальта
5+Co 4+Co 3+Co 2+Co 1+Co Co 01-Co
Технология получения
Металл извлекают из руды, преимущественно никелевой. На нее воздействуют растворенным аммиаком либо серной кислотой.
Применяется электролиз и дополнительное рафинирование (для получения более чистого продукта).
Нахождение в природе
Кобальт не сильно распространённый металл, скорее его можно отнести к редким, в земной коре присутствует в минимальных количествах. Насчитывается не более 30-ти минералов, в составе которых находится кобальт. Самое большое месторождение кобальта находится в Демократической Республике Конго, имеются залежи в США, Франции, Канаде и России.
Получение и марки кобальта
Получение нашего героя зависит от выплавки… меди и никеля. Наш герой — побочный продукт этих производств. Делается это методами пирометаллургии, выщелачиванием с последующей алюминотермией.
| Марка кобальта | Вид выпуска, содержание Co |
| К0 | не менее 99,98% Со |
| виталлиум | 62-65% Со |
| стеллита | 50% Со |
| викаллой | 52% Со |
| К2 | не менее 98,3% Со |
| ПК-1у | Порошок металлического кобальта, (Co не меньше 99,35%) |
Выпускается в виде проволоки, слитков, полос, пластин.
Достоинства и недостатки
Некоторые свойства кобальта обеспечивают металл рядом положительных характеристик. К преимуществам можно отнести хорошие показатели жаропрочности и стойкости к тепловым воздействиям, прочность даже при нагревании. Помимо этого элемент стоек к размагничиванию, так как это воздействие не влияет на него ни при повышении температуры, ни при механических нагрузках.
Из минусов отмечается в основном одно – высокая цена, так как этот металл относится к категории дорогостоящих.
Области применения
Данный элемент широко применяется в промышленной сфере, сельском хозяйстве, медицине. В чистой форме используется редко: радиоактивный металл нужен для γ-дефектоскопии и γ-терапии и для производства измерительных инструментов.
В основном он включается в сплавы для получения очень твердых и прочных материалов, постоянных магнитов. Такие варианты нужны для создания элементов авиационной техники, при строительстве ракет, в электротехнической и атомной отрасли.
Также элемент играет роль легирующей добавки в металлопрокате. Он улучшает режущие способности сталей и повышает температуру потери твердости. Благодаря такому влиянию его включают в состав тугоплавких и стойких к нагреву сплавов.
В атомной промышленности с его участием создают конструкционные элементы реакторов. Также применение кобальта достаточно интенсивно в области создания сплавов, стойких к кислотам и коррозии. В сочетании с никелем он применяется для нанесения защитного покрытия на готовые изделия, механизмы и детали.
В химической и нефтехимической промышленности металлический порошок нужен как катализатор, а в лакокрасочной, стекольной и керамической – для окрашивания.
Для медицины он также ценен, так как участвует в ходе лучевого лечения раковых заболеваний и стерилизации приборов. В сельском хозяйстве радиоактивный изотоп применяется для удаления насекомых в урожае, а соли элемента играют роль удобрения и подкормки для животных.
Кобальт в космосе
Казалось бы, «сверхскоростные» конструкции нужно делать из наиболее тугоплавких материалов, таких, как вольфрам, молибден, тантал. Эти металлы, конечно, играют видную роль, но не следует забывать, что и у них есть недостатки, ограничивающие возможности применения. При высоких температурах они сравнительно легко окисляются. Обработка их затруднительна. Наконец, они дороги. Поэтому их применяют, когда другими материалами нельзя обойтись, а во многих узлах вместо них работают сплавы на никелевой или кобальтовой основе.
 Самое широкое применение в авиационной и космической технике получили сплавы на основе никеля. Когда одного известного металловеда спросили, как он создает высокотемпературные сплавы, он ответил: «Я просто заменяю в сталях железо на никель».
Самое широкое применение в авиационной и космической технике получили сплавы на основе никеля. Когда одного известного металловеда спросили, как он создает высокотемпературные сплавы, он ответил: «Я просто заменяю в сталях железо на никель».
В тех же целях применяют сплавы на основе кобальта. Большая распространенность никелевых сплавов объясняется в основном их большей изученностью и меньшей стоимостью. Эксплуатационные же свойства сплавов на основе никеля и кобальта практически идентичны. Но «механизмы прочности» разные. Высокая прочность никелевых сплавов с титаном и алюминием объясняется образованием фазы-упрочнителя состава Ni3Al(Ti); чем больше в сплаве титана и алюминия, тем выше его механические свойства. Но при высоких температурах эксплуатации частицы фазы-упрочнителя переходят в раствор, и тогда сплав довольно быстро разупрочняется.
Кобальтовые же сплавы своей жаропрочностью обязаны образованию тугоплавких карбидов. Эти карбиды не растворяются в твердом растворе. Они обладают и малой диффузионной подвижностью. Правда, преимущества таких сплавов перед никелевыми проявляются лишь при температурах от 1038°С и выше. Последнее не должно смущать: известно, что чем выше температура, развивающаяся в двигателе, тем больше его эффективность. Кобальтовые сплавы хороши именно для наиболее эффективных высокотемпературных двигателей.
В конструкциях авиационных турбин применяют кобальтовые сплавы, которые содержат от 20 до 27% хрома. Этим достигается высокая «окалиностойкость» материала, позволяющая обходиться без защитных покрытий. Хром, кстати, единственный элемент, увеличивающий стойкость кобальта против окисления и одновременно его прочность при высокой температуре.
В лабораторных условиях сопоставляли свойства никелевых и кобальтовых сплавов под действием переменных температурных нагрузок (теплового удара). Испытания показали, что кобальтовые сплавы более «ударостойки». Не удивительно поэтому, что специалисты по космической технике все больше внимания уделяют сплавам элемента № 27. Это, если можно так выразиться, интерес с перспективой. Попробуем объяснить, что это значит, хотя бы на одном примере.
Все привычнее становятся полеты человека в космос. Но пока на экранах своих телевизоров мы видим лишь ракеты, получающие энергию в результате реакции окисления тех или иных топлив. Вряд ли этот вид «энергоснабжения» можно считать единственным и на будущее. Поднимутся ракеты, тягу которых создадут иные силы. В процессе разработки находятся электротермические, плазменные, ионные ракеты…
Важной составной частью двигательной установки любой из таких систем станет, по-видимому, электрогенератор. Электрогенератор большой мощности. Но, как мы знаем, мощные генераторы и весят много, и размеры имеют солидные. Как такую махину поместить на «транспортабельной установке»? Или — что практически более приемлемо — как сделать достаточно мощный и в то же время достаточно легкий генератор? Нужны оптимальные конструкции и оптимальные материалы для них.
В разрабатываемых проектах предусмотрен, в частности, атомный реактор с утилизацией тепла в паровой турбине. Крутить эту турбину будет не водяной пар, а ртутный (или пары щелочных металлов). В трубчатом бойлере тепло ядерной реакции испарит ртуть; ртутный пар, пройдя турбину и сделав свое дело, пойдет в конденсатор, где снова станет жидкостью, а затем опять, совершая круговорот, отправится в бойлер.
Такие аппараты должны работать без остановок, без осмотра и какого-либо ремонта не менее 10 тыс. часов, т. е. больше года. Судя по публикациям, бойлеры экспериментальных американских генераторов SNAP-2 и SNAP-8 сделаны из кобальтовых сплавов. Эти сплавы применили потому, что они жаропрочны, не подвержены амальгамации (не реагируют с ртутью), коррозионноустойчивы.
Кобальт в промышленности
Мы рассказали далеко не о всех областях применения кобальта. Совершенно не упомянули, например, о том, что электролитические кобальтовые покрытия во многих отношениях превосходят никелевые. Получить кобальтовое покрытие нужной толщины (причем равномерной толщины!) можно не за час, как никелевое, а всего за 4 минуты. Кобальтовые покрытия более тверды, поэтому защитный слой кобальта можно сделать тоньше, чем соответствующий слой никеля.
Русским ученым Федотьевым был в свое время исследовал кобальтовый сплав (до 75% кобальта), предназначенный для замены платиновых электродов гальванических ванн. Оказалось, что этот сплав не только не уступает драгоценному металлу, но и превосходит его по нерастворимости в крепких кислотах, а обходится несравненно дешевле.
Мы не замечаем, что кобальт окружает нас в нашей повседневной жизни, в быту, конкретнее — в эмалированных кастрюлях, причем не только синего цвета. Широко известный ныне процесс эмалирования жести рождался в муках. Эмаль накладывалась, но держалась плохо и отскакивала от основного металла при нагреве, толчке, а то и без всяких видимых причин. Лишь тогда, когда стали наносить эмаль в два слоя (грунт и эмаль), с содержанием в первом слое всего лишь 0,6% кобальта, покрытие стало удерживаться прочно. Объясняется же это тем, что в процессе нагрева окислы кобальта восстанавливаются железом до металла; этот кобальт при дальнейшем нагреве диффундирует в железо, образуя с ним твердый сплав. Мы сказали лишь о кастрюле, а сколько эмалированной посуды используется в медицине, фармацевтической, химической промышленности. И везде кобальт, всего лишь 0,6%.
Использование кобальта, его сплавов и соединений ширится с каждым днем. В последнее время, например, они стали нужны для изготовления ферритов, в производстве «печатных схем» в радиотехнической промышленности, при изготовлении квантовых генераторов и усилителей. Это металл с большим настоящим и большим будущим.
Как можно отравиться кобальтом?
Все острые и хронические отравления соединениями этого металла, как и им самим, в наше время почти исключительно встречаются на производстве. Попасть в организм кобальт может всеми путями. Наиболее часто он проникает через органы дыхания, в некоторых случаях – через кожу (перкутанно – перкутанный путь заражения), или алиментарно, то есть, попадая в рот.
Воздушный путь заражения чаще всего реализуется при работе с различными сыпучими материалами, которые содержат этот металл. Наиболее часто это возникает на заводах, связанных с технологией порошковой металлургии. Все процессы просева, разгрузки, выгрузки, калибровки порошков для производства кобальтово – вольфрамовых сплавов могут приводить к этим случаям. Кстати, если в организм попадает смесь титана и кобальта через легкие, то она вызывает более выраженный токсический эффект, чем каждый из этих элементов в отдельности.
Отравиться можно при работе с асбестоцементными изделиями, с жидким цементом, это риск для бетонщиков штукатуров. Поскольку кобальт применяется для создания красок, то высокий риск интоксикации у маляров, колеровщиков красок и стеклодувов.
Токсический эффект в острой форме сводится к поражению бронхолегочной системы, особенно страдает система кроветворения, пищеварительная и нервная система. Рассмотрим характерные признаки острой и хронической интоксикации кобальтом и его соединениями.
Аллергия на кобальт в стоматологии
Как известно, в ортопедической стоматологии применяется более 20 металлов. Развитию аллергии очень сопутствуют электрохимические процессы, которые протекают в полости рта в зависимости от состава металла, температуры, и химического состава слюны. В том случае, если в составе стоматологического сплава используется кобальт, или хром, то это может вызывать симптомы аллергического стоматита. Часто зубные коронки из сплавов хрома и кобальта вызывают аллергию – у таких пациентов после соединения с белками тканей организма атомы кобальта начинает проявлять антигенные свойства, хотя и невыраженные.
Однако нужно различать токсическую реакцию на металл протеза, и постепенно развившийся аллергический стоматит. В случае токсической реакции она развивается очень быстро, буквально через сутки после ортопедического лечения. Для правильной диагностики необходимо обязательно определить, есть ли токсическая доза кобальта и других тяжелых металлов в слюне, для чего проводится ее спектрограмма, а также необходимо снять зубной протез и провести элиминационную пробу.
Также в стоматологии проводятся иммунологические тесты, при которых определяют антитела не только к металлам, но и пластмассам. В том случае, если в слюне увеличено содержание кобальта, марганца, хрома или никеля, такие протезы необходимо убирать.
Но, прежде чем устанавливать протезы, содержащие тяжелые металлы, необходимо выявить наличие аллергии с помощью использования кожаных проб.
В заключение следует сказать, что вред кобальта для организма, конечно, существует, но в наше время отравиться можно только через профессиональные заболевания, поскольку острое отравление кобальтом и его солями в настоящее время стала клинической казуистикой. В качестве такого примера можно привести довольно редкие случаи заглатывания детьми магнитов, которые содержат кобальт. Под действием желудочного сока его сплавы переходят в растворимые соли, и всасываются в виде хлорида, что у малышей может привести к симптомам серьезного отравления. Поэтому соблюдение правил техники безопасности на производстве может полностью исключить возможность интоксикации.
Детский труд на богатейших шахтах
Конго — одна из беднейших и коррумпированных стран. Зато в ее недрах находятся бесценные сокровища. Страна занимает первое место в мире по добыче кобальта (около 60%). Добычу ведут в самодельных шахтах, практически руками и молотком. Треть из работающих в шахтах дети школьного возраста. За 12-ти часовой рабочий день малолетний работник получает 3-4 доллара США.
Остальные страны обделены этим ценным ресурсом:
- Канада — 6% мировой добычи кобальта.
- Австралия 4 %.
- Филиппины 4%.
- Куба 3%.
- Замбия 3%.
- Россия 3%.
Источники
- https://calcsbox.com/post/cobalt.html
- https://chem.ru/kobalt.html
- https://www.metotech.ru/kobalt-opisanie.htm
- https://kamniinfo.ru/metally/kobalt-chem-interesen-i-gde-ispolzuetsya-metall-kobalt-svoystva-kobalta-primenenie-kobalta.html
- http://himsnab-spb.ru/article/ps/co/
- https://k-tree.ru/tools/chemistry/periodic.php?element=Co
- https://jgems.ru/metally/kobalt
- https://calorizator.ru/element/co
- https://TheMineral.ru/metally/kobalt
- https://partalstalina.ru/kobalt-opisanie
- https://natural-museum.ru/chemistry/%D0%BA%D0%BE%D0%B1%D0%B0%D0%BB%D1%8C%D1%82-%D0%BF%D1%80%D0%B8%D0%BC%D0%B5%D0%BD%D0%B5%D0%BD%D0%B8%D0%B5
- https://xlom.ru/interesno/professionalnye-zabolevaniya/kobalt-i-ego-toksichnost-vred-i-polza-kobalta
Ваша оценка?

Петр Иваныч
Возможно этот человек ответит на ваши вопросы
Задать вопрос
Кобальт — серебристо-белый, с некоторым желтоватым оттенком, металл. В таблице Менделеева кобальт обозначается символом Co.
История кобальта
Искусные стекольные и гончарные мастера древности при выделке своих художественных изделий пользовались синей краской. В витринах Британского национального музея в Лондоне хранятся уникальные коллекции синих стекол, найденные археологами при раскопках памятников древней культуры в Египте и Ассиро-Вавилонии.
Ученых уже давно интересовал вопрос о природе этой любопытной синей краски, которая не утратила своих сильнокрасящих свойств в течение тысячелетий. Ряд специальных исследований, произведенных химиками, показал, что синие стекла, происходящие из Египта и Ассиро-Вавилонии, содержат соединения редкого элемента кобальта. Однако ученым так и не удалось окончательно разгадать, была ли известна древним мастерам способность окиси кобальта давать глубокое синее окрашивание, или они пользовались этим красящим материалом случайно, как и многими другими стойкими красками.
Неоднократно делались также попытки раскрыть тайну античных мастеров путем самого тщательного изучения синих стекол более позднего происхождения — александрийских, византийских и римских — в надежде найти в них присутствие кобальта. Но каково было удивление исследователей, когда они установили, что синяя краска этих стекол обусловлена наличием в них не кобальта, а меди. Не найдено было также кобальта в роскошных стеклянных и глиняных художественных изделиях, окрашенных в синий цвет, доставленных прославленным путешественником Марко Поло в Европу из стран азиатского материка.
Ремесленники средневековья совсем не применяли кобальта для окраски в синий цвет разнообразных изделий из стекла. В то время слово кобальт было ругательным именем для различных минералов, сопровождающих серебряные руды старинных месторождений в районе Саксонско-Богемского кряжа. Ненависть горняков и плавильщиков к кобальтy историки горного дела и металлурги объясняют тем, что его присутствие в шихте значительно затрудняло и удорожало проплавку серебряных руд.
Передовые ученые своей эпохи Агрикола, Парацельс и Василий Валентин упоминают, что «Cobold» — имя злого духа, который якобы обитает в недрах земли, расстраивает труд горняков и причиняет им всевозможные бедствия.
«Дух» ненавистного кобальта много столетий веял над рудниками Германии, и именем злого духа называли даже минералы, не содержащие кобальта, например, мышьяковистые руды, неблагоприятные свойства которых усугублялись, выделением ядовитых газов при их добыче и металлургической обработке.
Только в XVI столетии, когда добыча серебра из месторождений Саксонско-Богемского кряжа получила значительное развитие, были обнаружены сильные красящие свойства окиси кобальта. Но это новое интересное открытие около двух столетий держали в строжайшем секрете. Лишь узкий круг избранных владел секретом полезного использования красящих свойств кобальта.
Сохранились указания, что в 1533 году стекольный мастер Шюрер, проживавший в Богемии, успешно приготовлял кобальтовую синюю краску для окраски керамических изделий. Скоро голландские купцы заинтересовались новой красивой краской и с помощью Шюрера организовали ее производство у себя на родине. Первая саксонская мельница для размола кобальтовой краски была построена близ Аннаберга в 1649 году.
Теперь, когда кобальту была открыта широкая дорога в промышленность, его соединения начали быстро внедряться в качестве ценных красок для стекол, глазури, фарфора, эмалей и ряда других продуктов керамики.
Химические свойства кобальта
Но какова же природа кобальта, и не является ли он смесью некоторых «земель», к которым пионеры теоретической химии относили большинство известных им минеральных видов?
Над научной расшифровкой этой задачи много потрудился швед Брандт, который в своей диссертации (написанной в 1735 г.) «О полуметаллах» впервые сообщил, что висмут, полученный из кобальто-висмутовых руд, не чист, а содержит кобальт, который может быть отделен механическим путем. Эта первая попытка разгадать природу кобальтовых руд была подхвачена учеными в различных странах.
На рубеже XIX в. продукция соединений кобальта исчислялась уже сотнями тонн в год. В науку вошли исследования Бергмана, составившего в 1787 году довольно полное описание химических свойств кобальта, отличающих его от никеля.
Из таблицы периодической системы элементов можно узнать, что порядковое число кобальта равно 27, а его атомный вес 58,94. В этой таблице кобальт стоит между железом и никелем, что соответствует непрерывному закономерному изменению свойств элементов в периодической системе Д. И. Менделеева. Постепенно ученым удалось установить, что по своим физическим и химическим свойствам кобальт больше приближается к никелю, чем к железу.
Некоторые характерные химические свойства кобальта как бы заранее предопределили его практическое использование в технике.
Кобальт — металл, который достаточно устойчив против разрушительного действия атмосферных агентов. При обыкновенной температуре он мало поддается действию воды и воздуха. Значительно легче окисляется мелкораздробленный кобальт, но и в этом случае образующаяся на поверхности металла пленка окислов предохраняет его от дальнейшего окисления. Однако с повышением температуры этот процесс заметно активизируется. Единственной кислотой, быстро растворяющей кобальт при комнатной температуре, является азотная.
В своей автобиографии Генри Бессемер пространно рассказывает, что он переплавил не одну сотню мешков русских медных монет. Это было еще тогда, когда все помыслы молодого и инициативного Генри были сосредоточены на том, чтобы получить тончайший пылевидный материал (так называемый «китайский порошок») для позолоты различных предметов. Бессемер установил, что лучшее сырье для получения «золотой» пыли, дающей сверкающие золотистые оттенки и искристые переливы – русская медная монета. В русских копейках, привлекших внимание предприимчивого Бессемера присутствовал кобальт.
Применение кобальта
Многочисленны по составу и оттенкам технические сорта, изготовляемых в наши дни, красок из кобальта. Широким распространением пользуются красивые и очень прочные краски под названием смальта и окислы кобальта. Это незаменимый материал для окраски некоторых стекол, эмалей и изделий из керамики. Особенность синих кобальтовых стекол заключается в том, что они прозрачны для красного света. Именно на этом свойстве и основано их применение в химическом анализе в качестве световых фильтров для определения окраски пламени. Получила широкое распространение турецкая зелень, которую применяют для окраски фарфора.
В малярном деле и в производстве керамике применяется небесно-голубая краска, единственная краска, обладающая хорошей кроющей способностью. Для акварельных и малярных красок в керамике применяется желтая краска, или соль Фишера. Окислы кобальта приобрели большое значение в технике эмалирования жести и в производстве лаков.
Выдающаяся роль принадлежит кобальту в новейших сверхтвердых и магнитных сплавах. Кобальтовые твердые сплавы (сюда относятся кобальтовые легированные стали) завоевали важные области применения в металлообрабатывающей промышленности. Ценные свойства обеспечивают им распространение в разных отраслях индустрии. Вот далеко не полный арсенал изделий, содержащих кобальт: фрезы, сверла, измерительные приборы, штампы, части молотов, шестеренки, зубчатки, валы, подшипники и т. д.
История кобальта
С историей открытия кобальта связано немало легенд и преданий, в средние века люди были уверены, что здесь не обошлось без вмешательства нечистой силы. Ведь недаром название кобальт происходит от немецкого Kobolt – зловредный карлик, маленький гном, который строил всяческие козни, мешая рудокопам Саксонии заниматься добычей руды и выплавкой металла. Некоторые руды, добытые в Саксонии, имели серебристый цвет и поначалу считались серебром. Но металл, получаемый из этих руд, давал ядовитые пары, которыми неоднократно были отравлены рудокопы (calorizator). В 1735 году химик из Швеции Георг Брандт выделил из «руды нечистой силы» металл серебристо-розоватого оттенка, который был назван кобольд. Впоследствии название преобразовалось в известное и привычное нам.
Общая характеристика кобальта
Кобальт является элементом IX группы IV периода периодической системы химических элементов Д.И. Менделеева, с атомным номером 27 и атомной массой 58,9332. Признанное обозначение кобальта – Co (от латинского Cobaltum).

Нахождение в природе
Кобальт не сильно распространённый металл, скорее его можно отнести к редким, в земной коре присутствует в минимальных количествах. Насчитывается не более 30-ти минералов, в составе которых находится кобальт. Самое большое месторождение кобальта находится в Демократической Республике Конго, имеются залежи в США, Франции, Канаде и России.
Физические и химические свойства
Кобальт является твёрдым металлом серебристо-белого цвета, со слегка розоватым (реже – синим) отливом. При взаимодействии с воздухом окисление происходит при высоких температурах (300˚С и выше).
Суточная потребность в кобальте
Суточная потребность в кобальте очень невелика, обычно составляет 0,1 – 0,8 мг для здорового взрослого человека. Обычно дневную норму кобальта человек получает из пищи.
Продукты питания богатые кобальтом
Основные источники кобальта:
- фасоль и зелёный горошек
- баранья и говяжья печень
- печень трески
- морепродукты и жирные сорта рыб
- свёкла, зелёные листовые овощи
- манка, некоторые виды хлеба
- земляника
- молоко, сыры.
Признаки нехватки кобальта
Признаками нехватки в организме человека кобальта являются участившиеся заболевания системы кровообращения и эндокринной. Причиной недостатка кобальта обычной служат хронические заболевания органов пищеварения (гастрит, язва двенадцатиперстной кишки).
Применение кобальта в жизни
Кобальт нашёл широкое применение в виде сплавов – в металлургической промышленности для повышения жаропрочности стали, в производстве магнитов, как состав красителей – в изготовлении стекла и керамики.
Полезные свойства кобальта и его влияние на организм
Кобальт – один из жизненно важных микроэлементов, присутствие его в организме человека обязательно. Кобальт входит в состав витамина В12, принимает участие в синтезе ДНК и аминокислот, в расщеплении белков, жиров и углеводов. Активно влияет на обменные процессы организма, особую роль играет в кроветворении – стимулирует рост и развитие эритроцитов. Кобальт поддерживает нормальную деятельность поджелудочной железы и регуляцию активности адреналина.

Автор: Виктория Н. (специально для Calorizator.ru)
Копирование данной статьи целиком или частично запрещено.


